
ҰңМвДүҰүғӘЛ®КЗТ»ёцңЮөуµД»ҮС§ЧКФө±¦үвӘ¬АыУГғӘЛ®үЙТФ»сµГРнРн¶а¶а»Ү№¤ІъЖ·ҰӘ
ӘЁ1Ә©УЙғӘЛ®Й№СОЦЖµГµДВИ»ҮДЖүЙУГУЪВИәҵµДФБПӘ¬ТФЙъІъЙХәоә°ЗвЖшҰұВИЖшӘ¬ёГµзҢв·өУ¦µДАлЧУ·ҢіМКҢОҒ ҰӘ
ӘЁ2Ә©АыУГЦЖСОғуµДСОВ±МбИҰдеµД№¤ТХБчіМИзПВ(Іү·ЦІЩЧчғНМхәюТСВФИӨ)Әғ
СОВ±![]() µНЕЁ¶ИBr2
µНЕЁ¶ИBr2![]() ИЬТғұс
ИЬТғұс![]() Br2
Br2
РөіцBr2УлNa2CO3ИЬТғ·өУ¦µДАлЧУ·ҢіМКҢ(МбКңӘғСх»ҮІъОпУл»№ФІъОпОпЦКµДБүЦ®±ИОҒ1ҰГ5) ҰӘ
ӘЁ3Ә©СОВ±Хф·ұАдИөғуОціцВ±үйµДЦчТҒіЙ·ЦКЗMgCl2Ә¬өЛНв»№ғ¬Fe2+ҰұFe3+ҰұMn2+µИАлЧУӘ¬ТФВ±үйОҒФБПЦЖµГГңµД№¤ТХБчіМИзПВ(Іү·ЦІЩЧчғНМхәюТСВФИӨ)Әғ
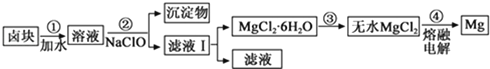
ТСЦҒЙъіЙЗвСх»ҮОпіБµнµДpHИзПВӘғ
іБ µн Оп | үҒ Кә іБ µн | іБ µн Нк И« |
Fe (OH)3 | 2.7 | 3.7 |
Fe (OH)2 | 7.6 | 9.6 |
Mn (OH)2 | 8.3 | 9.8 |
Mg (OH)2 | 9.6 | 11.1 |
ұЩІҢЦиұЪЦРРиүШЦЖpH=9.8Ә¬ЖдДүµДКЗ ҰӘ
ұЪУГNaClO Сх»ҮFe2+µГµҢFe (OH)3іБµнµДАлЧУ·ҢіМКҢКЗӘғ ҰӘ
ұЫNaClO»№ДЬіэИӨСОВ±ЦРµДДтЛШ[CO (NH2)2]Ә¬ЙъіЙСОАаОпЦКғНДЬІОУлөуЖшС»·µДОпЦКӘ¬УР№Ш·өУ¦ФАнОҒӘғ3NaClO+ CO (NH2)2 ЁT 3NaCl+CO2Ұь+N2Ұь+2H2O ҰӘЗлДгәЖЛгИфіэИӨСОВ±ЦРғ¬УРµД0.1mol CO (NH2)2К±РиПығДNaClO gҰӘ
Ұңөр°ёҰү
ӘЁ1Ә©2ClЁD+2H2O![]() Cl2Ұь+H2Ұь+2OH ЁD
Cl2Ұь+H2Ұь+2OH ЁD
ӘЁ2Ә©3Br2+3CO32ЁD= BrO3ЁD+5BrЁD+3CO2Ұь Ә»
ӘЁ3Ә©ұЩК№ИЬТғЦРғ¬УРµДFe2+ҰұFe3+ҰұMn2+ФУЦКНкИ«ЙъіЙіБµн¶шіэИӨ ұЪClOЁD+2Fe2++5H2O=2 Fe (OH)3Ұэ+ClЁD+4H+ ұЫ 22.35
ҰңҢвОцҰү
КФМв·ЦОцӘғӘЁ1Ә©µзҢвВИ»ҮДЖИЬТғФЪТхә«ЙъіЙЗвСх»ҮДЖғНЗвЖшӘ¬Сфә«ЙъіЙВИЖшӘ¬ЖдµзҢв·өУ¦µДАлЧУ·ҢіМКҢКЗ2Cl-+2H2O![]() Cl2Ұь+H2Ұь+2OH-Ә¬№Көр°ёОҒӘғ2Cl-+2H2O
Cl2Ұь+H2Ұь+2OH-Ә¬№Көр°ёОҒӘғ2Cl-+2H2O![]() Cl2Ұь+H2Ұь+2OH-Ә»
Cl2Ұь+H2Ұь+2OH-Ә»
ӘЁ2Ә©Br2УлNa2CO3·өУ¦ЙъіЙNaBrO3ҰұNaBrғНCO2Ә¬BrФҒЛШІү·ЦУЙ0әЫЙэёЯµҢ+5әЫӘ¬БнТ»Іү·ЦөУ0әЫҢµµНµҢ-1әЫӘ¬ФтЙъіЙµДNaBrO3УлNaBrµДОпЦКµДБүЦ®±ИОҒ1Әғ5Ә¬ЛщТФЕдЖҢ·ҢіМКҢОҒӘғ3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2ҰьӘ¬№Көр°ёОҒӘғ3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2ҰьӘ»
ӘЁ3Ә©СОВ±әУЛ®ИЬҢвӘ¬әУNaClOҢ«Fe2+Сх»ҮіЙFe3+Ә¬И»ғуәУИлNaOHµчҢЪpHОҒ9.8Ә¬К№Fe2+ҰұFe3+ҰұMn2+ЧҒ»ҮОҒЗвСх»ҮОпіБµнӘ¬№эВЛӘ¬ВЛТғң№эХф·ұЕЁЛхҰұАдИөҢбң§Ұұ№эВЛµГµҢӘ¬ВИ»ҮГңң§МеӘ¬ФЪHClЖш·ХЦРәУИИµГµҢОЮЛ®ВИ»ҮГңӘ¬µзҢвИЫИЪµДВИ»ҮГңµГµҢMgӘ»
ұЩІҢЦиұЪЦРРиүШЦЖpH=9.8ФЪУЪК№іэMg2+ТФНвµДёчЦЦФУЦКҢрКфАлЧУ¶әЙъіЙЗвСх»ҮОпіБµнӘ¬ТФ±гНЁ№э№эВЛ¶шіэИӨӘ¬әөүШЦЖpH=9.8µДДүµДӘғіэИӨИЬТғЦРғ¬УРµДFe2+ҰұFe3+ҰұMn2+ФУЦКӘ¬К№Ц®НкИ«ЙъіЙіБµн¶шіэИӨӘ»№Көр°ёОҒӘғіэИӨИЬТғЦРғ¬УРµДFe2+ҰұFe3+ҰұMn2+ФУЦКӘ¬К№Ц®НкИ«ЙъіЙіБµн¶шіэИӨӘ»
ұЪәУИлөОВИЛбДЖ»бСх»ҮСЗМъАлЧУОҒИэәЫМъӘ¬ФтөОВИЛбДЖУлFe2+ҰұH2O·өУ¦ЙъіЙFe(OH)3ҰұCl-ғНH+Ә¬·өУ¦µДАлЧУ·ҢіМКҢОҒӘғClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+Ә»№Көр°ёОҒӘғClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+Ә»
ұЫNaClO»№ДЬіэИӨСОВ±ЦРµДCO(NH2)2Ә¬ЙъіЙСОғНДЬІОУлөуЖшС»·µДОпЦКӘ¬Жд·өУ¦ОҒ3NaClO+CO(NH2)2ЁT3NaCl+CO2Ұь+N2Ұь+2H2OӘ¬УЙ·ҢіМКҢЦРОпЦКЦ®әдµД№ШПµүЙЦҒӘ¬0.1mol CO(NH2)2ПығДNaClOОҒ0.3molӘ¬Фтm(NaClO)=nM=0.3molҰБ74.5g/mol=22.35gӘ¬№Көр°ёОҒӘғ22.35ҰӘ



| Дкә¶ | ёЯЦРүОіМ | Дкә¶ | іхЦРүОіМ |
| ёЯТ» | ёЯТ»Гв·СүОіМНЖәцӘҰ | іхТ» | іхТ»Гв·СүОіМНЖәцӘҰ |
| ёЯ¶ю | ёЯ¶юГв·СүОіМНЖәцӘҰ | іх¶ю | іх¶юГв·СүОіМНЖәцӘҰ |
| ёЯИэ | ёЯИэГв·СүОіМНЖәцӘҰ | іхИэ | іхИэГв·СүОіМНЖәцӘҰ |
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүПЦУРИэЧйИЬТғӘғұЩЖыУНғНВИ»ҮДЖИЬТғ ұЪ39%µДТТөәИЬТғ ұЫВИ»ҮДЖғНµӨЦКдеµДЛ®ИЬТғӘ¬·ЦАлТФЙПёч»мғПТғµДХэИ··Ң·ЁТАөОКЗ( )
AӘ®ХфБуҰұЭНИҰҰұ·ЦТғ BӘ®·ЦТғҰұЭНИҰҰұХфБу
CӘ®ЭНИҰҰұХф·ұҰұ·ЦТғ DӘ®·ЦТғҰұХфБуҰұЭНИҰ
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүғӘСуЦРµДЙғғчіжңИзПВ·өУ¦РОіЙКҮ»ТКҮНвүЗӘ¬Ңш¶шРОіЙЙғғчӘғCa2+ + 2HCO3- ![]() CaCO3Ұэ + H2O + CO2 ҰӘУлЙғғчіж№ІЙъµДФеАа»бПығДғӘСуЦРµДCO2ҰӘЖшғт±дЕҮҰұОВКТР§У¦µДәУңзёЙИЕБЛЙғғчіжµДЙъі¤Ә¬ЙхЦБЦВЖдЛАНцҰӘПВБРЛµ·ЁІ»ғПАнµДКЗ
CaCO3Ұэ + H2O + CO2 ҰӘУлЙғғчіж№ІЙъµДФеАа»бПығДғӘСуЦРµДCO2ҰӘЖшғт±дЕҮҰұОВКТР§У¦µДәУңзёЙИЕБЛЙғғчіжµДЙъі¤Ә¬ЙхЦБЦВЖдЛАНцҰӘПВБРЛµ·ЁІ»ғПАнµДКЗ
AӘ®№ІЙъФеАаПығДCO2Ә¬УРАыУЪЙғғчµДРОіЙ
BӘ®ғӘСуЦРCO2ЕЁ¶ИЙэёЯӘ¬ТЦЦЖБЛЙғғчµДРОіЙ
CӘ®ОВ¶ИЙэёЯ»бФцөуCO2ФЪғӘЛ®ЦРµДИЬҢв¶ИӘ¬ТЦЦЖБЛЙғғчµДРОіЙ
DӘ®Ң«CO2ЧҒ»ҮОҒәЧөәµИ»Ү№¤ФБПӘ¬УРЦъУЪ»ғҢвОВКТР§У¦
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүПВБР±д»ҮКфУЪ»ҮС§±д»ҮµДКЗ
AӘ®ЖыУН»У·ұ BӘ®Иә·ЕСМ»Ё CӘ®»оРФМүОьёҢ±щПдДЪТмО¶ DӘ®·ЦАлТғМ¬үХЖшЦЖСхЖш
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүПВБРУР№Ш»щ±ңУҒСшОпЦКµДЛµ·ЁЦРӘ¬өнОуµДКЗ
AӘ®µн·ЫУцµв»ҮәШИЬТғ±дА¶
BӘ®ЖПМСМЗғН№ыМЗ»ӨОҒН¬·ЦТм№№Ме
CӘ®АыУГУНЦ¬ФЪәоРФМхәюПВЛ®ҢвүЙЦЖИҰ·КФн
DӘ®УГЧЖЙХІұОЕЖшО¶µД·Ң·Ёәш±рСтГ«ЦҮОпғНГЮЦҮОп
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүЛжЧЕүЖС§әәКхµД·ұХ№Ә¬РВІДБПІгіцІ»ЗоӘ®ПВБРКфУЪҢрКфІДБПµДКЗӘЁ Ә©
AӘ®ЙъОпМХөЙ BӘ®ёЦ»ҮІӘБ§ CӘ®оСғПҢр DӘ®ңЫЛД·ъТТП©
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүҰ°3GҰ±КЦ»ъіцПЦғуӘ¬ТФ№вµәПЛО¬ОҒ»щөҰµДёЯЛЩРЕПұНЁµАУИПФЦШТҒӘ®ПВБРОпЦКЦРУГУЪЦЖФм№вµәПЛО¬µДІДБПКЗӘЁ Ә©
AӘ®НғПҢр BӘ®МХөЙ CӘ®ңЫТТП© DӘ®¶юСх»Ү№и
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүµзАлЖҢғвіӘКэКЗғвБүИхµзҢвЦКµзАліМ¶ИµДБүҰӘТСЦҒИзПВ±нКэңЭ(25 Ұж)Әғ
»ҮС§КҢ | µзАлЖҢғвіӘКэ |
HCN | KӘҢ4.9ҰБ10Ә10 |
CH3COOH | KӘҢ1.8ҰБ10Ә5 |
H2CO3 | K1ӘҢ4.4ҰБ10Ә7Ә¬K2ӘҢ4.7ҰБ10Ә11 |
ӘЁ1Ә©25 ҰжК±Ә¬µИЕЁ¶ИµДИэЦЦИЬТғ(AӘ®NaCNИЬТғҰұBӘ®Na2CO3ИЬТғҰұCӘ®CH3COONaИЬТғ)µДpHУЙөуµҢРҰµДЛіРтОҒ________________________________ҰӘ(МоРөРтғЕ)
ӘЁ2Ә©25 ҰжК±Ә¬ПтNaCNИЬТғЦРНЁИлЙЩБүCO2Ә¬Лщ·ұЙъ·өУ¦µД»ҮС§·ҢіМКҢОҒ______ ___ҰӘ
ӘЁ3Ә©ПЦУРЕЁ¶ИОҒ0.02 mol/LµДHCNУл0.01mol/L NaOHµИМе»э»мғПғуӘ¬ІвµГc(Na+)Әңc(CN-)Ә¬ПВБР№ШПµХэИ·µДКЗ ҰӘ
AӘ®c(H+)Әңc(OH-)
BӘ®c(H+)Әәc(OH-)
CӘ®c(H+)+c(HCN) = c(OH-)
DӘ®c(HCN)+ c(CN-)=0.01mol/L
ӘЁ4Ә©ЕЁµДAl2(SO4)3ИЬТғғНЕЁµДРҰЛХөт(NaHCO3)ИЬТғ»мғПүЙУГУЪГр»рӘ¬ЗлУГАлЧУ·өУ¦·ҢіМКҢ±нКңГр»рµДФАн_____________________ҰӘ
ӘЁ5Ә©ТСЦҒNaHC2O4Л®ИЬТғПФЛбРФӘ¬ЗлРөіцёГИЬТғЦРёчАлЧУЕЁ¶ИµДөуРҰ___________________Ә»µзғЙКШғг±нөпКҢ ___________________ ҰӘ
ӘЁ6Ә©H2C2O4ИЬТғғНKMnO4ЛбРФИЬТғүЙ·ұЙъ·өУ¦ӘғH2C2O4Ә«MnO4-Ә«HӘ«ҰъCO2Ә«Mn2Ә«Ә«H2OӘ¬·өУ¦ЦРГүЙъіЙ±күцПВ4.48LCO2ЖшМеӘ¬ЧҒТЖµДµзЧУµДОпЦКµДБүОҒ__________molҰӘ
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүәғЦҒC8H11NµДН¬·ЦТм№№МеЦРғ¬УР±Ң»·µДУРғЬ¶аЦЦӘЁІ»үәВЗБұМеТм№№Ә©Ә¬ЖдЦР±Ң»·ЙПУРТ»ёцІаБөҰұ¶юёцІаБөғНИэёцІаБөµДЦЦКэ·Ц±рКЗ
AӘ®5Ұұ9Ұұ6 BӘ®4Ұұ6Ұұ6 CӘ®3Ұұ9Ұұ7 DӘ®4Ұұ6Ұұ7
Ійүөөр°ёғНҢвОц>>
№ъәКС§РӘУЕСҰ - Б·П°ІбБР±н - КФМвБР±н
ғю±±КҰ»ӨБҒНшОӨ·ЁғНІ»БәРЕПұңЩ±ЁЖҢМЁ | НшЙПУРғ¦РЕПұңЩ±ЁЧЁЗш | µзРЕХ©ЖңЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРғ¦РЕПұңЩ±ЁЧЁЗш | ЙжЖуЗЦИЁңЩ±ЁЧЁЗш
ОӨ·ЁғНІ»БәРЕПұңЩ±Ёµз»°Әғ027-86699610 ңЩ±ЁУКПдӘғ58377363@163.com