
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.蒸馏、萃取、分液 B.分液、萃取、蒸馏
C.萃取、蒸发、分液 D.分液、蒸馏、萃取
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序( )
①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.④②⑤ B.④①②⑤③ C.②⑤④①③ D.①④②⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
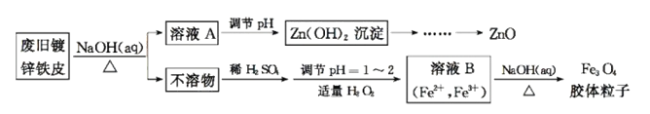
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有 。(填字母序号)
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是 。
(3)? (填“能”或“不能”)。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取 g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有 (用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将 (填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对于化学反应提出了w原子经济性。(原子节约)的新概念及要求理想的原子经济性反应是原料中的原子全部转变成所需产物不产生副产物实现零排放。下列反应为合成相应有机产物的反应原理原子利用率期望产物的总质量与生成物的总质量之比)最差的是(反应均在定条件下进行)
A.CH2=CH2 +Cl2 +Ca(OH)2→CaCl2+H2O +![]()
B.2CH3-CH=CH2+2NH3+3O2→2CH2=CH-CN+6H2O
C.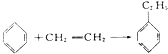
D.2CH2=CH2+O2→2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2
D.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种常用绿色氧化剂,在化学研究中应用广泛
(1)常温下,用CO、O2和水在三苯基膦肥钯的催化下即可制得H2O2。相对于电解氢氧化钠溶液制H2O2,该方法的优点是最安全、___。
(2)图1是铝/过氧化氢电池结构示意图,铝电极为_________(填“正极”或“负极”)。石墨电极的电极反应式为_______________-
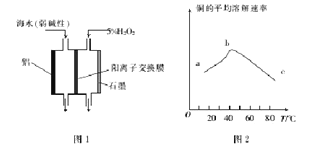
(3)印刷电路板中的金属铜可用10%的H2O2 溶液和0.3mol·L-1的H2SO4溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示,其中bc段曲线变化的主要原因是_________.
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验。将表中所给的溶液分别加入A、B、C、D4个反应瓶中,手机产生的气体,记录数据
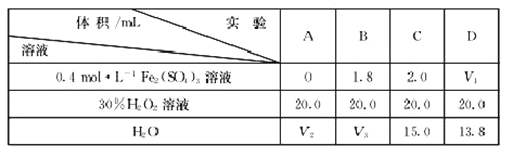
①记录的数据为__________。
②上表中的V3=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁:装置如图所示。
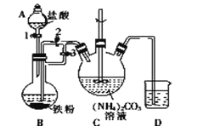
(1)B中可观察到的现象是铁粉逐渐溶解,_________________________。
将B中生成的FeCl2溶液压入装置C的操作是______________________。
Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
(2)加入少量铁粉的作用是___________________,反应后加入适量乳酸的作用是________________。
(3)从所得溶液中获得乳酸亚铁晶体所需的实验操作是______ _、______、洗涤、干燥。
(4)设计实验证明乳酸亚铁中含Fe2+ ____________________ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:

已知:3NO3-+8Al+5OH-+2H2O![]() 3NH3↑+8AlO2-
3NH3↑+8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得许许多多化工产品。
(1)由海水晒盐制得的氯化钠可用于氯碱工业的原料,以生产烧碱及氢气、氯气,该电解反应的离子方程式为 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
盐卤![]() 低浓度Br2
低浓度Br2![]() 溶液Ⅰ
溶液Ⅰ![]() Br2
Br2
写出Br2与Na2CO3溶液反应的离子方程式(提示:氧化产物与还原产物物质的量之比为1∶5) 。
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子,以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
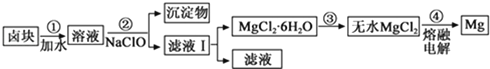
已知生成氢氧化物沉淀的pH如下:
沉 淀 物 | 开 始 沉 淀 | 沉 淀 完 全 |
Fe (OH)3 | 2.7 | 3.7 |
Fe (OH)2 | 7.6 | 9.6 |
Mn (OH)2 | 8.3 | 9.8 |
Mg (OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe (OH)3沉淀的离子方程式是: 。
③NaClO还能除去盐卤中的尿素[CO (NH2)2],生成盐类物质和能参与大气循环的物质,有关反应原理为:3NaClO+ CO (NH2)2 ═ 3NaCl+CO2↑+N2↑+2H2O 。请你计算若除去盐卤中含有的0.1mol CO (NH2)2时需消耗NaClO g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com