
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁:装置如图所示。
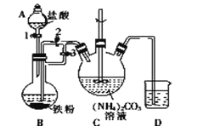
(1)B中可观察到的现象是铁粉逐渐溶解,_________________________。
将B中生成的FeCl2溶液压入装置C的操作是______________________。
Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
(2)加入少量铁粉的作用是___________________,反应后加入适量乳酸的作用是________________。
(3)从所得溶液中获得乳酸亚铁晶体所需的实验操作是______ _、______、洗涤、干燥。
(4)设计实验证明乳酸亚铁中含Fe2+ ____________________ _。
【答案】(1)有气泡冒出,溶液变成浅绿色;关闭活塞3,打开活塞2(各2分)
(2)防止Fe2+被氧化;除去铁粉(各1分)
(3)冷却结晶;过滤(各1分)
(4)取少量乳酸亚铁溶液于试管中,先滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色(或其他合理答案)(2分)
【解析】
试题分析:(1)Fe与稀盐酸会发生反应:Fe+2HCl=FeCl2+H2↑,因此会观察到有气泡冒出,溶液变成浅绿色;将B中生成的FeCl2溶液压入装置C的操作是关闭活塞3,打开活塞2,在氢气压强的作用下,FeCl2溶液被压入装置C;(2)Fe2+具有还原性,容易被装置中的空气氧化产生Fe3+,为防止其变质,要加入还原铁粉;Fe是比较活泼的金属,可以与酸发生反应,所以反应后加入适量乳酸的作用是除去过量的铁粉;(3)乳酸亚铁的溶解度受温度的影响变化较大,从所得溶液中获得乳酸亚铁晶体所需的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(4)证明乳酸亚铁中含Fe2+的实验是取少量乳酸亚铁溶液于试管中,先滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色。


科目:高中化学 来源: 题型:
【题目】下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
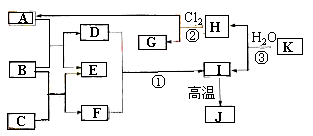
请按要求回答下列问题:
⑴写出B元素在周期表中的位置 K的化学式______________ 。
⑵反应①的离子方程式为_______________ 。
⑶将D的溶液蒸干且将所得的固体物质灼烧得到___________固体(写化学式),若要由D得溶液得到无水的D的固体,请简述其处理方法______________
⑷反应②进行的条件通常是 ,H和Cl2反应产物中有一种产物M的结构能证明G一定为正四面体结构请写出M的电子式 。
⑸J与焦炭在高温的情况下可以生成K和二氧化碳,请写出该反应的方程式____________ ;在此反应中氧化剂与还原剂的质量之比为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.蒸馏、萃取、分液 B.分液、萃取、蒸馏
C.萃取、蒸发、分液 D.分液、蒸馏、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据下面流程,回答以下问题:
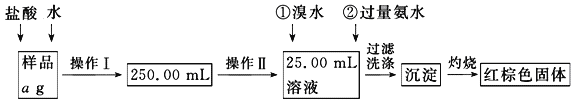
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有___________、___________(填仪器名称),操作Ⅱ必须用到的仪器是___________(填编号)。
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式_________________,加入氨水要过量的原因是________________。
(3)检验沉淀是否已经洗涤干净的操作是____________________。
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是_________ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_________________________。(写出一种原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)
![]()
![]()
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A | 乙酸具有酸性 | 常用于除水垢 |
B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
C | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2+ + 2HCO3- ![]() CaCO3↓ + H2O + CO2 。与珊瑚虫共生的藻类会消耗海洋中的CO2。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是
CaCO3↓ + H2O + CO2 。与珊瑚虫共生的藻类会消耗海洋中的CO2。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是
A.共生藻类消耗CO2,有利于珊瑚的形成
B.海洋中CO2浓度升高,抑制了珊瑚的形成
C.温度升高会增大CO2在海水中的溶解度,抑制了珊瑚的形成
D.将CO2转化为甲醇等化工原料,有助于缓解温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要.下列物质中用于制造光导纤维的材料是( )
A.铜合金 B.陶瓷 C.聚乙烯 D.二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com