
| A. | 油脂在体内完全氧化时,提供的能量比糖类和蛋白质约高一倍 | |
| B. | 利用油脂在碱性条件下水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化,即与氢气发生加成反应,可以制造植物奶油(人造奶油) | |
| D. | 天然油脂没有固定的熔沸点 |
分析 油脂是高级脂肪酸与甘油形成的酯.是油与脂肪的统称,高级脂肪酸的烃基中含有不饱和键呈液态称为油,不含不饱和键呈固态为脂肪.依据结构分析选项.
解答 解:A、油脂在体内完全氧化时,大约可以产生39.8千焦的热能,提供的能量比糖类和蛋白质约高一倍,是产生能量最高的营养物质,与碳碳双键无关,故A错误;
B、油脂是高级脂肪酸与甘油形成的酯,碱性条件下水解得甘油和肥皂,与碳碳双键无关,故B错误;
C、植物油高级脂肪酸烃基中含有不饱和键,经过氢化(加氢),可以变成脂肪,故C正确;
D、天然油脂是混合物无固定的熔沸点,与碳碳双键无关,故D错误;
故选C.
点评 本题主要考查了油脂的组成与性质以及在人体作用,难度较小,平时要有意识进行知识积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y与Z形成的化合物都可以和盐酸反应 | |
| C. | 简单阴离子的还原性:Y>W | |
| D. | Z与Q形成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
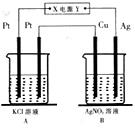 如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答:
如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | 30 | 30 | 30 | 30 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | 20 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素是典型的非金属元素,因此不能与其他非金属元素化合 | |
| B. | 卤素单质越活泼,其熔、沸点就越高 | |
| C. | 卤素单质都能和水剧烈反应 | |
| D. | 卤素单质都能和H2反应,且气态氢化物的稳定性随单质氧化性的增强而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
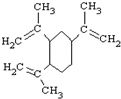
| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 榄香烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 1mol榄香烯最多能和3molH2反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com