
分析 H3PO4?H++H2PO4-K1=7.1×10-3;H2PO4-?H++HPO42-K2=6.3×10-8;HPO42-?H++HPO43-K3=4.2×10-13;上一级电离产生的H+对下一级电离有抑制作用;为获得尽可能纯的NaH2PO4,需H2PO4-浓度最大,根据K1、K2、以及pH=-lgc(H+)计算;若向Na2HPO4溶液中加入足量的CaCl2溶液,HPO42-离子和Ca2+离子反应生成沉淀,促进HPO42-的电离,溶液显示酸性.
解答 解:为获得尽可能获得NaH2PO4,需配制磷酸、磷酸二氢钠的缓冲溶液,当溶液全部为磷酸溶液时,磷酸以第一步电离为主,所以H3PO4?H++H2PO4-K1=7.1×10-3;PH=-lgc(H+)=3-lg7.1≈2.1,
当溶液全部为NaH2PO4溶液时,H2PO4-?H++HPO42-K2=6.3×10-8,所以pH=-lgc(H+)=8-lg6.3≈7.2,
所以pH应控制介于2.1~7.2之间;HPO42-离子既能发生电离又能发生水解,电离反应式为HPO42-?PO43-+H+,水解反应式为HPO42-+H2O?H2PO4-+OH-,溶液呈碱性,说明水解程度大于电离程度;由于HPO42-离子和Ca2+离子反应生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,促进HPO42-的电离,溶液则显酸性;
故答案为:2.1~7.2;3Ca2++2HPO42-=Ca3(PO4 )2↓+2H+.
点评 本题考查了弱电解质的电离、pH的计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握多元弱酸电离平衡的特点.


科目:高中化学 来源: 题型:选择题
| A. | 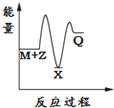 | B. | 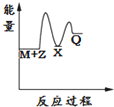 | C. | 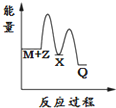 | D. | 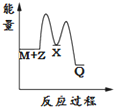 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与W的最高正价之和为11 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | 原子半径由大到小的顺序为W、Z、Y、X | |
| D. | Y分别与X、Z形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 区分淀粉溶液和鸡蛋清溶液 | B. | 鉴别乙酸和乙醇 | ||
| C. | 鉴别自来水与豆浆 | D. | 鉴别乙酸乙酯与饱和Na0H溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在体内完全氧化时,提供的能量比糖类和蛋白质约高一倍 | |
| B. | 利用油脂在碱性条件下水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化,即与氢气发生加成反应,可以制造植物奶油(人造奶油) | |
| D. | 天然油脂没有固定的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
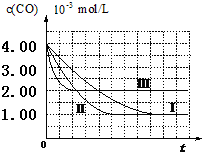 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com