
【题目】若在加入铝粉能放出H![]() 的溶液中,下列各组离子一定不能大量共存的是
的溶液中,下列各组离子一定不能大量共存的是
A. Na![]() 、Fe
、Fe![]() 、SO
、SO![]() 、Cl
、Cl![]()
B. Ba![]() 、Mg
、Mg![]() 、HCO
、HCO![]() 、NO
、NO![]()
C. Na![]() 、K
、K![]() 、NO
、NO![]() 、CO
、CO![]()
D. K![]() 、NO
、NO![]() 、AlO
、AlO![]() 、OH
、OH![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li +nS![]() Li2Sn。有关该电池的说法正确的是
Li2Sn。有关该电池的说法正确的是

A. 放电时,Li+向负极迁移
B. 充电时,A电极连接电源的负极
C. 充电时,每生成n mol S转移2n mol电子
D. 放电时,正极上可发生反应2Li+ +2Li2S6+2e-=3Li2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉、铜粉混合物样品11.6 g,逐滴加入2.0 mol·L-1的硫酸溶液,充分反应后剩余固体质量随加入硫酸溶液体积变化如下表:
硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
请回答:
(1)样品中铁与铜的物质的量之比n(Fe)∶n(Cu)=________。
(2)在反应后的体系中,再加入4.0 mol·L-1的H2O2溶液25.0 mL,并加入足量硫酸溶液。充分反应后溶液中存在的各金属离子的物质的量分别是多少?__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体。教师结合小明已有知识设计了下图所示装置进行实验。
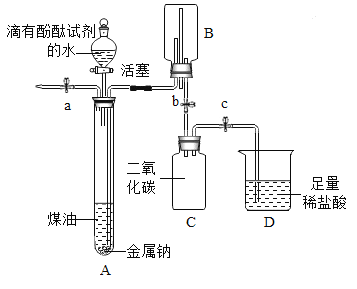
【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL。
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是__________。
(2)实验过程
操作 | 现象及解释 | |
① | 打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞。 | 液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中。由此可知金属钠的物理性质_______(写出一点即可)。 |
② | 打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b。 | 反应的化学方程式为_____________. |
③ | 打开止水夹c。 | _______,溶液红色消失。 反应的化学方程式为_________。 |
④ | 将燃着的木条伸到导管尖嘴处,打开止水夹a; 在火焰上方罩一个干冷的烧杯。 | 气体燃烧,产生淡蓝色火焰 烧杯内壁有无色液滴生成,A中气体为氢气。 |
(3)反思分析
金属钠与水反应的化学方程式为_____________;
反应结束,C中溶液的溶质是_________(指示剂除外,写出所有可能)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 沸水中滴入FeCl3饱和溶液:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
![]()
C. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
D. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,雾霾又上了度娘热搜榜。其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质。
①写出该反应的化学反应方程式:_____________。
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2= -1269.02kJ mol-1。105℃时,则上述脱硝反应的△H=_______,该反应________(填“能” “否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为________。每生成1mol还原产物,则反应中转移电子数为_________mol。
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |

0~10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁、铜四种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A.Cu2+
B.AlO2-
C.Al3+
D.Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com