
【题目】近日,雾霾又上了度娘热搜榜。其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质。
①写出该反应的化学反应方程式:_____________。
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2= -1269.02kJ mol-1。105℃时,则上述脱硝反应的△H=_______,该反应________(填“能” “否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为________。每生成1mol还原产物,则反应中转移电子数为_________mol。
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |

0~10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
【答案】4NH3+6NO=5N2+6H2O-1811.63kJ·mol-1能3∶240.02<0.5L·mol-1D<
【解析】
(1)①根据题意,两种无毒物质是水和N2,故反应方程式为4NH3+6NO=5N2_+6H2O;
②已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)____△H1=-907.28kJ__mol-1;②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=_-1269.02kJ__mol-1;根据盖斯定律可知由②×![]() -①×
-①×![]() 得反应4NH3+6NO=5N2_+6H2O,该反应的ΔH=(_-1269.02kJ__mol-1)×
得反应4NH3+6NO=5N2_+6H2O,该反应的ΔH=(_-1269.02kJ__mol-1)×![]() -(-907.28kJ__mol-1)×
-(-907.28kJ__mol-1)×![]() =-1811.63kJ·mol-1;该反应放热,且S_>0,G<0,故反应能自发。
=-1811.63kJ·mol-1;该反应放热,且S_>0,G<0,故反应能自发。
③该反应中氧化剂为NO,还原剂为NH3,物质的量之比为3∶2,且根据氧化剂为NO可知,每生成1mol还原产物,则反应中转移电子数为4mol。
(2)①读图可知,0~10min内甲容器中N2O5的浓度变化量为0.2mol·L-1,2NO2(g)+O3(g)===N2O5(g)+O2(g),则消耗O3的浓度为0.2mol·L-1,反应速率V(O3)=0.02mol·(L·min)-1。
②由图象知,容器乙先达到平衡,温度高,即T1<T2,
2NO2(g)+O3(g)![]() N2O5(g)+O2(g)
N2O5(g)+O2(g)
起始浓度(mol/L) 2 1 0 0
变化浓度(mol/L) 1 0.5 0.5 0.5
平衡浓度(mol/L) 1 0.5 0.5 0.5
T1时,该反应的平衡常数K=![]() =0.5;
=0.5;
③A项,向容器中充入He,增大容器的压强,但不改变反应速率和平衡。B项,由图象知,该反应提高温度,反应逆向进行。C项,向容器中充入一定量的NO2,NO2的转化率降低。D项,向容器中再充入1mol O3和2mol NO2,相当于加压,平衡正向移动;故答案为D;
④若起始时向容器甲中充入2mol NO2、1mol O3、2mol N2O5和2mol O2,计算浓度商Qc=![]() =1,相当于加入五氧化二氮反应逆向进行,则脱硝反应达到平衡前,v(正)<v(逆)。
=1,相当于加入五氧化二氮反应逆向进行,则脱硝反应达到平衡前,v(正)<v(逆)。


科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

请回答下列问题:
(1)非诺洛芬中的含氧官能团为________________(填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为______________。
(3)在上述五步反应中,属于取代反应的是_______________(填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:_______________。
(5)根据已有知识并结合相关信息,写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]()
合成路线流程图第一步已给出,请补充完整。
 _________________________________________。
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出H![]() 的溶液中,下列各组离子一定不能大量共存的是
的溶液中,下列各组离子一定不能大量共存的是
A. Na![]() 、Fe
、Fe![]() 、SO
、SO![]() 、Cl
、Cl![]()
B. Ba![]() 、Mg
、Mg![]() 、HCO
、HCO![]() 、NO
、NO![]()
C. Na![]() 、K
、K![]() 、NO
、NO![]() 、CO
、CO![]()
D. K![]() 、NO
、NO![]() 、AlO
、AlO![]() 、OH
、OH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂所用试剂和操作不合理的是
选项 | 物质(括号中为杂质) | 除杂试剂 | 分离方法 |
A | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
B | 硝酸钾(NaCl) | 水 | 降温结晶 |
C | 淀粉(NaCl) | 水 | 渗析 |
D | NaCl溶液(Na2S) | AgCl | 过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将m1 g样品加热,其质量变为m2 g,则该样品的纯度(质量分数)是( )
A. (84m2-53m1)/31m1×100% B. 84(m1-m2)/31m1×100% C. (73m2-42m1)/31m1×100% D. (115m2-84m1)/31m1×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有NH4+、Na+、Fe2+和K+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量的盐酸,溶液中物质的量几乎不变的阳离子是
A.NH4+
B.Na+
C.Fe2+
D.K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
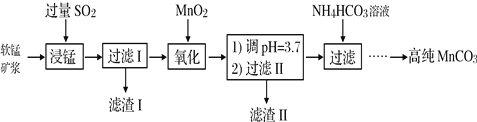
(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com