
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
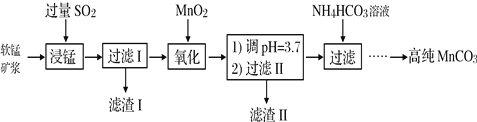
(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
【答案】 2Fe3++ SO2+2H2O = 2Fe2+ + SO42-+4H+ Mn2+ Fe2+ MnO2+SO2=MnSO4 90℃ 防止NH4HCO3受热分解,提高原料利用率 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 取1-2mL最后一次洗液于试管,滴加盐酸酸化BaCl2溶液,若无白沉淀产生,则洗涤干净
【解析】(1)反应ⅱ是溶液中的Fe3+氧化SO2生成硫酸,本身还原为Fe2+,发生反应的离子方程式为2Fe3++ SO2+2H2O = 2Fe2+ + SO42-+4H+ ;
(2)浸锰操作时MnO2被SO2还原为Mn2+,则过滤Ⅰ所得滤液中主要存在的两种金属阳离子为Mn2+、Fe2+ ;
(3)氧化过程中MnO2被还原为Mn2+,SO2被氧化为SO42-,发生反应的化学方程式为MnO2+SO2=MnSO4;
(4)由图示可知温度在90℃左右时,锰的浸出率最高,此时MnS2O6的生成率最低,则“浸锰”的适宜温度是90℃;因NH4HCO3稳定性差,受热易分解,向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是 防止NH4HCO3受热分解,提高原料利用率;
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,此气体应为CO2,发生反应的离子方程式为Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(6)生成的MnCO3沉淀表面附着液中含有SO42-,则检验洗涤是否完全的方法是取1-2mL最后一次洗液于试管,滴加盐酸酸化BaCl2溶液,若无白沉淀产生,则洗涤干净。


科目:高中化学 来源: 题型:
【题目】近日,雾霾又上了度娘热搜榜。其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质。
①写出该反应的化学反应方程式:_____________。
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2= -1269.02kJ mol-1。105℃时,则上述脱硝反应的△H=_______,该反应________(填“能” “否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为________。每生成1mol还原产物,则反应中转移电子数为_________mol。
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |

0~10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁、铜四种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A.Cu2+
B.AlO2-
C.Al3+
D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④ B.①②③④ C.①④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是

A. MOH为一元强碱
B. K点对应的溶液中:c(M+) + c(MOH) = c(A-)
C. K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol·L-1
D. N点水的电离程度小于K点水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取50 mL H+浓度为0.2 mol·L-1的盐酸和硫酸的混合溶液,加入50 mL Ba(OH)2溶液充分反应,得到沉淀0.233 g,反应后溶液中OH-浓度为0.01 mol·L-1(假设反应后溶液的总体积为100 mL)。
请计算:
(1)原混合酸溶液中H+的物质的量为__________ mol。
(2)加入的Ba(OH)2溶液的物质的量浓度为__________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com