
【题目】下列除杂所用试剂和操作不合理的是
选项 | 物质(括号中为杂质) | 除杂试剂 | 分离方法 |
A | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
B | 硝酸钾(NaCl) | 水 | 降温结晶 |
C | 淀粉(NaCl) | 水 | 渗析 |
D | NaCl溶液(Na2S) | AgCl | 过滤 |
A. A B. B C. C D. D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将一定量Fe和Fe2O3混合物放入2mol·L-1的HNO3溶液25 mL中,反应完成后,无固体剩余,生成224 mL NO气体(标准状况),再向反应后的溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
A.45 mL B.50 mL C.40 mL D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体。教师结合小明已有知识设计了下图所示装置进行实验。
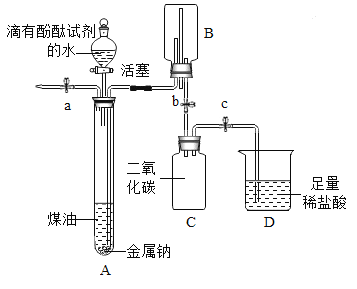
【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL。
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是__________。
(2)实验过程
操作 | 现象及解释 | |
① | 打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞。 | 液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中。由此可知金属钠的物理性质_______(写出一点即可)。 |
② | 打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b。 | 反应的化学方程式为_____________. |
③ | 打开止水夹c。 | _______,溶液红色消失。 反应的化学方程式为_________。 |
④ | 将燃着的木条伸到导管尖嘴处,打开止水夹a; 在火焰上方罩一个干冷的烧杯。 | 气体燃烧,产生淡蓝色火焰 烧杯内壁有无色液滴生成,A中气体为氢气。 |
(3)反思分析
金属钠与水反应的化学方程式为_____________;
反应结束,C中溶液的溶质是_________(指示剂除外,写出所有可能)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 沸水中滴入FeCl3饱和溶液:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
![]()
C. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
D. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图,下列有关A的说法正确的是( )

A.分子式为C14H25O6NBr
B.该分子中含有两个手性碳原子
C.不能使酸性高锰酸钾溶液褪色
D.A在一定条件下与氢氧化钠溶液反应,1 mol A最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,雾霾又上了度娘热搜榜。其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质。
①写出该反应的化学反应方程式:_____________。
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2= -1269.02kJ mol-1。105℃时,则上述脱硝反应的△H=_______,该反应________(填“能” “否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为________。每生成1mol还原产物,则反应中转移电子数为_________mol。
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |

0~10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液。
(1)该溶液中存在的三个平衡体系是 、 、 。(用离子方程式表示)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是 。
(5) 和 两种粒子数量之和比OH-多0.008mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④ B.①②③④ C.①④ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com