
����Ŀ���о�CO2��CH4�ķ�Ӧʹ֮ת��ΪCO��H2���Լ���ȼ��Σ������������ЧӦ������Ҫ�����塣
(1)��֪CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H����248kJ��mol��1����S��310J mol-1��K-1���÷�Ӧ���Է����е��¶ȷ�ΧΪ____________________��
2CO(g)��2H2(g) ��H����248kJ��mol��1����S��310J mol-1��K-1���÷�Ӧ���Է����е��¶ȷ�ΧΪ____________________��
(2)���ܱպ���������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol��L��1��CH4��CO2����һ�������·�����Ӧ
CH4(g)��CO2(g)![]() 2CO(g)��2H2(g)�����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
2CO(g)��2H2(g)�����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��

�ٹ�ҵ����ʱһ���ѡ��P4��1250����кϳɣ��������ԭ��__________________________��
����ѹǿΪP4��1100��������£��÷�Ӧ5minʱ�ﵽƽ���X������CO��ʾ�÷�Ӧ������Ϊ________________�����¶��£���Ӧ��ƽ�ⳣ��Ϊ_____________________(����3λ��Ч����)��
(3) CO��H2�ڹ�ҵ�ϻ�����ͨ����ӦC(s)��H2O(g) ![]() CO(g)��H2 (g)����ȡ���ں��º����£�����ӷ�Ӧ���������ƽ�⣬���϶��Ѵ�ƽ��״̬����________________________��
CO(g)��H2 (g)����ȡ���ں��º����£�����ӷ�Ӧ���������ƽ�⣬���϶��Ѵ�ƽ��״̬����________________________��
A����ϵѹǿ���ٱ仯 B��H2��CO��H2O�����ʵ���֮��Ϊ1:1:1
C�����������ܶȱ��ֲ��� D������ƽ����Է����������ֲ���
(4) ����ȼ�ϵ�ؿ����������������ʡ���ͼ�����ü���ȼ�ϵ�ص��100mL 1mol��L -1ʳ��ˮ,���һ��ʱ���,�ռ�����״���µ�����2.24L(�������Һ�������)��
�ټ���ȼ�ϵ�صĸ�����Ӧʽ: _____________________________________________
�ڵ�����Һ��pH= __________________________(��������������������Һ��Ӧ)��
�������������������ڱ�״������ __________________L
���𰸡�����800K �ϴ��ѹǿ���¶��ܼӿ�ϳ����ʣ��������Ч�� 0.032mol��L��1��min��1 1.64 ACD CH4 +2H2O -8e-=CO2 +8H+ 14 1.68
��������
(1)����![]() ���㷴Ӧ���Է����е��¶ȷ�Χ��(2) �ٹ�ҵ����Ҫ��Ҫ���Ƿ�Ӧ������Ҫ���Ƿ�Ӧ�����������á�����ʽ�����㷴Ӧ���ʺ�ƽ�ⳣ����(3)����ƽ���־������(4) �����������£������ڸ���ʧ���ӷ�������������Ӧ�����ɶ�����̼������������ʳ��ˮ�е��Ȼ��Ƶ����ʵ�����0.1mol���������ʳ��ˮ�Ļ�ѧ����ʽ
���㷴Ӧ���Է����е��¶ȷ�Χ��(2) �ٹ�ҵ����Ҫ��Ҫ���Ƿ�Ӧ������Ҫ���Ƿ�Ӧ�����������á�����ʽ�����㷴Ӧ���ʺ�ƽ�ⳣ����(3)����ƽ���־������(4) �����������£������ڸ���ʧ���ӷ�������������Ӧ�����ɶ�����̼������������ʳ��ˮ�е��Ȼ��Ƶ����ʵ�����0.1mol���������ʳ��ˮ�Ļ�ѧ����ʽ![]() ��������0.1mol����ʱ������0.2mol�Ȼ��ƣ��Ȼ��Ʋ��㣬�����ȵ�ⱥ��ʳ��ˮ������ˮ���۸��ݵ�ʧ�����غ����������������������
��������0.1mol����ʱ������0.2mol�Ȼ��ƣ��Ȼ��Ʋ��㣬�����ȵ�ⱥ��ʳ��ˮ������ˮ���۸��ݵ�ʧ�����غ����������������������
(1)����![]() ��
��![]() ��Ӧ���Է�����������
��Ӧ���Է�����������![]() ��Ӧ���Է�������(2) �ٽϴ��ѹǿ���¶��ܼӿ�ϳ����ʣ��������Ч�������Թ�ҵ����ʱѡ��P4��1250�����CH4(g)��CO2(g)
��Ӧ���Է�������(2) �ٽϴ��ѹǿ���¶��ܼӿ�ϳ����ʣ��������Ч�������Թ�ҵ����ʱѡ��P4��1250�����CH4(g)��CO2(g)![]() 2CO(g)��2H2(g)��Ӧ����
2CO(g)��2H2(g)��Ӧ����
CH4(g)��CO2(g)![]() 2CO(g)��2H2(g)
2CO(g)��2H2(g)
��ʼ 0.1 0.1 0 0
ת�� 0.08 0.08 0.16 0.16
ƽ�� 0.02 0.02 0.16 0.16
��CO��ʾ�÷�Ӧ������Ϊ![]() 0.032mol��L��1��min��1 �����¶��£���Ӧ��ƽ�ⳣ��Ϊ
0.032mol��L��1��min��1 �����¶��£���Ӧ��ƽ�ⳣ��Ϊ![]() 1.64 �� (3) A���÷�Ӧǰ������ϵ�����DZ���������������ѹǿ�DZ���������ϵѹǿ���ٱ仯��һ���ﵽƽ��״̬����ѡA�� B��H2��CO��H2O�����ʵ���֮��Ϊ1:1:1ʱ����һ�����ٸı������Է�Ӧ��һ���ﵽƽ��״̬���ʲ�ѡB�� C������
1.64 �� (3) A���÷�Ӧǰ������ϵ�����DZ���������������ѹǿ�DZ���������ϵѹǿ���ٱ仯��һ���ﵽƽ��״̬����ѡA�� B��H2��CO��H2O�����ʵ���֮��Ϊ1:1:1ʱ����һ�����ٸı������Է�Ӧ��һ���ﵽƽ��״̬���ʲ�ѡB�� C������![]() �����������DZ����������ܶ��DZ��������������ܶȱ��ֲ�����һ���ﵽƽ��״̬����ѡC �� D����Ӧ�������������ƽ����Է���������С��ƽ����Է��������DZ�������������ƽ����Է����������ֲ�����һ���ﵽƽ��״̬����ѡD��(4) �����������£������ڸ���ʧ���ӷ�������������Ӧ�����ɶ�����̼�������ӣ�������Ӧʽ��CH4 +2H2O -8e-=CO2 +8H+����ʳ��ˮ�е��Ȼ��Ƶ����ʵ�����0.1mol���������ʳ��ˮ�Ļ�ѧ����ʽ
�����������DZ����������ܶ��DZ��������������ܶȱ��ֲ�����һ���ﵽƽ��״̬����ѡC �� D����Ӧ�������������ƽ����Է���������С��ƽ����Է��������DZ�������������ƽ����Է����������ֲ�����һ���ﵽƽ��״̬����ѡD��(4) �����������£������ڸ���ʧ���ӷ�������������Ӧ�����ɶ�����̼�������ӣ�������Ӧʽ��CH4 +2H2O -8e-=CO2 +8H+����ʳ��ˮ�е��Ȼ��Ƶ����ʵ�����0.1mol���������ʳ��ˮ�Ļ�ѧ����ʽ![]() ��������0.1mol����ʱ������0.2mol�Ȼ��ƣ��Ȼ��Ʋ��㣬���Ե��ʳ��ˮ��ʼ��Cl-��H+�ŵ磬Cl-�ŵ���Ϻ���OH���ŵ硣0.1mol�Ȼ��������������Ƶ����ʵ�����0.1mol���������Ƶ�Ũ����
��������0.1mol����ʱ������0.2mol�Ȼ��ƣ��Ȼ��Ʋ��㣬���Ե��ʳ��ˮ��ʼ��Cl-��H+�ŵ磬Cl-�ŵ���Ϻ���OH���ŵ硣0.1mol�Ȼ��������������Ƶ����ʵ�����0.1mol���������Ƶ�Ũ����![]() ��PH=14�������ݢڵķ���������������0.05mol�����������������������ݵ�ʧ�����غ㣬��������0.025mol�����Ա�״���µ������1.68L��
��PH=14�������ݢڵķ���������������0.05mol�����������������������ݵ�ʧ�����غ㣬��������0.025mol�����Ա�״���µ������1.68L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
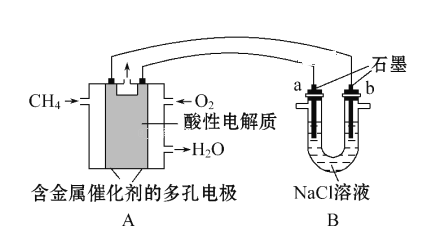
����Ŀ������ͼ��ʾװ�ó�ȥ��CN����Cl����ˮ�е�CN��ʱ��������ҺPHΪ9~10������������ClO����CN������Ϊ��������Ⱦ�����壬����˵������ȷ����

A. ��ʯī����������������
B. �����ĵ缫��ӦʽΪ��Cl�� + 2OH����2e��= ClO�� + H2O
C. �����ĵ缫��ӦʽΪ��2H2O + 2e�� = H2�� + 2OH��
D. ��ȥCN���ķ�Ӧ��2CN��+ 5ClO�� + 2H+ = N2�� + 2CO2�� + 5Cl��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܱ������з�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)��673K��30MPa��n(NH3)��n(H2)��ʱ��仯��ϵ��ͼ������������ȷ���ǣ� ��
2NH3(g)��673K��30MPa��n(NH3)��n(H2)��ʱ��仯��ϵ��ͼ������������ȷ���ǣ� ��
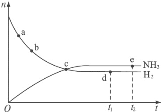
A. ��ͬ�����ʱ�ʾ������Ӧ���ʣ���a�ȵ�b��С
B. ��c����Ӧ�ﵽƽ��
C. ��d (t1ʱ��)�͵�e(t2ʱ��)��n(N2)��һ��
D. �ڸ��������£�t1ʱ��NH3�ĺ����ﵽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�ķ���ʽ��ȷ����( )
A. ��̼��������θ�����![]()
B. �ð�ˮ���������еĶ�������![]()
C. �ѽ����Ʒ�����ˮ�в�������![]()
D. ������������Һ�����ܽ�������������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���(C6H5CH2Cl)Ϊ��ɫҺ�壬��һ����Ҫ���л�����ԭ�ϡ�����ʵ����ģ�ҵ���üױ�����������ڹ��������¼��ȷ�Ӧ�ϳ��Ȼ��С�������Ȼ��в�������Ʒ�Ĵ��ȣ���װ��(�г�װ����ȥ)��ͼ��ʾ��

�ش��������⣺
(1)����E��������_____________����������_______________________________________��
(2)װ��B�е���ҺΪ___________________��
(3)�ú�ѹ��Һ©�������Һ©�����ŵ���__________________________________________��
(4)װ��A�з�Ӧ�����ӷ���ʽΪ__________________________________________________��
(5)��Ӧ�����ر�K1��K2����K3������������ƿ��������Ȼ��У�Ӧѡ���¶ȷ�ΧΪ______����
���� | �ܽ��� | �۵㣨�棩 | �е㣨�棩 |
�ױ� | ������ˮ�������Ҵ��������Ȼ��� | ��94.9 | 110 |
�Ȼ��� | ����ˮ�������ڱ����ױ����л��ܼ� | ��39 | 178.8 |
���Ȼ��� | ������ˮ�������Ҵ������� | ��16 | 205 |
���Ȼ��� | ������ˮ�������Ҵ����������� | ��7 | 220 |
(6)����Ȼ�����Ʒ�Ĵ��ȣ�
�ٳ�ȡ13.00g��Ʒ���ձ��У�����50.00mL 4 molL��1 NaOHˮ��Һ��ˮԡ����1Сʱ����ȴ�����35.00mL 40% HNO3���ٽ�ȫ����Һת�Ƶ�����ƿ�����100mL��Һ��ȡ20.00mL��Һ���Թ��У�����������AgNO3��Һ����������ˡ�ϴ�ӡ����������������Ϊ2.87g�������Ʒ�Ĵ���Ϊ_____%(�������С�����1λ)��
��ʵ�ʲ����������ƫ�ߣ�ԭ����__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȷ������ӣ�ϸ���ڴ�л���ʢ����������ӣ�ϸ���ڴ�л��������˵��(����)
A. ˮ��ϸ���ڴ�л��IJ���
B. ����ˮ��ϸ���ڴ�л��ı�Ҫ����
C. ˮ��ϸ���ڵ���Ҫ�ɷ�
D. ���������ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý���п��ϡ���ᷴӦ���ʵIJⶨ������˵��������ǣ� ��
��װ�ã�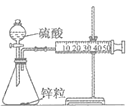 ��װ�ã�
��װ�ã�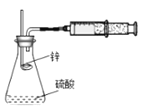
A. ����װ�÷�Һ©����������Һ©�����Һ��˳�����£�������˵������װ�������Բ���
B. ��Ҫ������λʱ���ڲ����������������һ�������������Ҫ��ʱ��
C. ��װ����Ϊ��μ������ᣬ����������Ũ�ȵı仯�����������װ�ÿ��Լ�С������װ����ȼ�ճ������ƶ���
D. ֻ��Ҫ����װ����п����ΪͭƬ��ϡ�����ΪŨ���ᣬ�Ϳ����ô�װ�òⶨͭ��Ũ����ķ�Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ����
A.2��3��������2���һ�����
B.2��5��5����������
C.3���һ���3��������
D.3��3����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ����Һ���������÷ų�����, ����Һ��һ���ܴ����������������
A.Cl-��SO42-��Na+��K+B.K+��CO32-��Ca2+��NO3-
C.HCO3-��Na+��NO3-��K+D.NO3-��Cu2+��Cl-��NH4+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com