
 Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
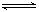 Ba2+(aq)+ CO32-(aq),尽管c(Ba2+)=" 1.0" × 10-4mol·L-1 < 2×10-3 mol·L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。
Ba2+(aq)+ CO32-(aq),尽管c(Ba2+)=" 1.0" × 10-4mol·L-1 < 2×10-3 mol·L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。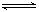 Ba2+(aq)+ CO32-(aq),尽管c(Ba2+)=" 1.0" × 10-4mol·L-1 < 2×10-3 mol·L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。
Ba2+(aq)+ CO32-(aq),尽管c(Ba2+)=" 1.0" × 10-4mol·L-1 < 2×10-3 mol·L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题

| A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 |
| B.图中x点的坐标为(100,6 ) |
| C.图中x点表示溶液中Ag+ 与Cl- 浓度相同 |
| D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
| A.Ksp(CuCO3)<Ksp(CaCO3) | B.c(Cu2+)<c(Ca2+) |
C.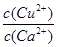 > > | D.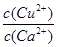 < < |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B.25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)<V(NaOH) |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.AgCl沉淀易转化成AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.298K时,CaSO4的溶解度约为7.00×10-2 mol/L |
| B.反应CaSO4(s) + CO32-= CaCO3(s) + SO42-在298K时的平衡常数K= Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104 |
| C.CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质 |
| D.升高温度,两种盐的溶度积与溶解度都保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.①② | C.③④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是| A.溶液中Ca2+离子数目减少 | B.溶液c(Ca2+)减小 |
| C.溶液的C(OH-)增大 | D.溶液中溶质的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在一定温度下AgCl水溶液中Ag+和Cl—浓度的乘积是一个常数 |
| B.AgCl水溶液的导电性很弱,所以AgCl为弱电解质 |
| C.温度一定时,当AgCl水溶液中Ag+和Cl—浓度的乘积等于KSP值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入盐酸,c(Cl—)增大,KSP值变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com