
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) 2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
D.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.电解精炼铜时,若阳极质量减少64g,则转移到阴极的电子不一定等于2NA
B.1molNa2O2晶体中共含有4NA个离子
C.1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA
D.常温下pH=1的H2SO4溶液中,H+的浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:填空题
(10分)自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g) 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
时间(s) | 0 | 10 | 20 | 25 | 30 |
条件A [n(NO2)](mol) | 0.20 | 0.14 | 0.13 | 0.13 | 0.13 |
条件B [n(NO2)](mol) | 0.20 | 0.10 | 0.10 | 0.10 | 0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列各组离子中,在给定条件下能够大量共存的是
A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32-
B.无色溶液中:Mg2+、MnO4-、SO42-、K+
C.酸性溶液中可能大量存在Na+、ClO?、SO42?、I?
D.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
依据氧化还原反应:Cu2+(aq)+Fe(s)= Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是
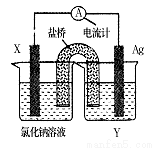
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,X电极反应为:O2+2H2O+4e- =4OH-
D.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
将标准状况下的V L HCl(气)溶于1000g水中,得到的盐酸密度为ρ g/cm3,则该盐酸的物质的量浓度为
A.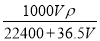 mol/L B.
mol/L B.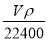 mol/L
mol/L
C.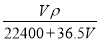 mol/L D.
mol/L D.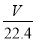 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:填空题
(10分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:_____ClO3-+______Fe2++______ =_____Cl-+_____Fe3++______
(3)FeCl3 在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2 Fe(OH)++H2O
Fe(OH)2++H+ K2 Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月月考化学试卷(解析版) 题型:填空题
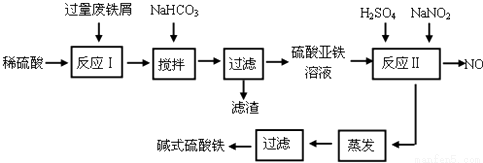
(17分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)如何加快废铁屑的溶解,写出两种办法_____________________。
(2)加入少量NaHCO3的目的是调节pH在_________________范围内。
(3)反应Ⅱ中加入NaNO2的目的是__________________。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为_________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_______________。
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素总含量为g/L。若滴定前溶液中H2O2没除尽,所测定的铁元素的含量将会____________(填“偏高”“偏低”“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:选择题
一种新型净水剂PAFC(聚合氯化铁铝,[AlFe(OH)nCl6-n]m,,n<5,m<10},广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是
A.PAFC用于净化饮用水时,可以除去水中所有的有害物质
B.PAFC中铁显+2价
C.PAFC可溶于盐酸
D.PAFC没有氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com