
【题目】某潜艇上的核反应堆内使用了液体铝钠合金作载热介质,下列关于Al、Na原子结构的分析中正确的是
A. 原子半径:Al>Na B. 第一电离能:Al<Na
C. 基态原子未成对电子数:Na = Al D. 硬度:Na>Al
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
Ⅰ.该同学应称取NaOH固体________g。容量瓶的使用之前需要_____。溶液的配置过程操作步骤如图2所示,则图1操作应在图2中的___(填选项字母)之间。操作②中液体转移到容量瓶要注意__________。图⑤操作的名称是________,进行该操作时要注意_________________。
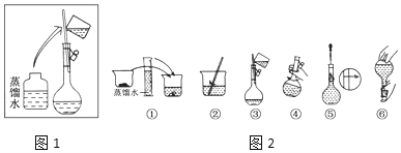
A.②与③ B.①与② C.④与⑤ D.⑤与⑥
Ⅱ.实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶
F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
A.Th元素的质量数是232
B.230Th和232Th的化学性质相同
C.232Th转化成233U是化学变化
D.Th元素的相对原子质量是231
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A. 滴定管下端连有橡皮管的为酸式滴定管
B. 在滴定时,左手操作锥形瓶,右手操作滴定管开关
C. 滴定前应首先排除尖嘴部分的气泡
D. 滴定过程中两眼应注视滴定管内液面的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去括号内杂质的试剂或操作正确的是
A.Al2O3(SiO2):水B.NH4Cl(I2):加热
C.CO2(SO2):饱和NaHSO3溶液D.HCl(Cl2):苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃A可以合成扁桃酸也可以合成H。以下是合成线路(部分产物、反应条件已略去):
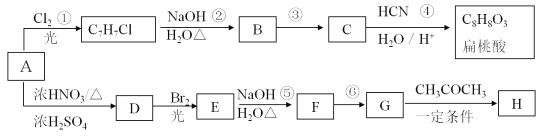
已知:
I.R-CHO+ HCN →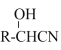
II.R-CN![]() R-COOH
R-COOH
III. 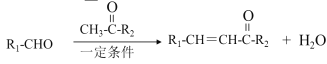
IV.D的相对分子质量为137
请回答下列问题:
(1)扁桃酸中含氧官能团的名称是_______;物质B 的结构简式_______ 。
(2)上述①~⑥反应中属于取代反应的有________ 。
(3)关于H物质,下列说法正确的是______(填字母序号)。
A.所有碳原子可能处于同一平面
B.可以发生加成反应、聚合反应、氧化反应和还原反应
C.H 与G 都能与新制Cu(OH)2反应
(4)写出反应⑥的化学方程式_______________。
(5)X 是扁桃酸的同分异构体,1molX 可与2molNa2CO3 反应,其核磁共振氢谱有四组峰,峰面积之比为3 :2 :2 :1,其结构简式为_________(任写两种)。
(6)请结合所学知识和上述信息,写出由A 和乙醛为原料(无机试剂任用)制备肉桂醛(![]() )的合成路线流程图_______________。
)的合成路线流程图_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
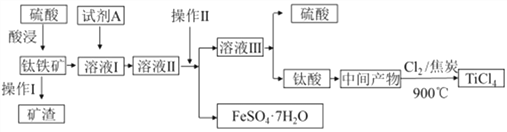
请答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中钛元素的化合价为_____。
(2)试剂A为____,加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
“溶液II经“操作II"可得副产品FeSO4·7H2O,则“操作II”包括浓缩、冷却、_____。
(3)若“溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过__。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
已知TiO2(s)+2Cl2(g)=TiC14(l)+O2(g) △H=+151kJ/mol,该反应极难进行,当向反应体系中加入焦炭后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是_______。
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与不同浓度的硫酸反应时,硫酸的还原产物为SO2或H2。为验证这一事实,某同学用下图装置在室温下进行实验。
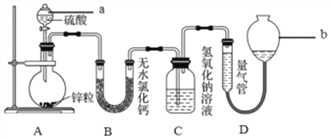
请回答下列问题:
(1)仪器a的名称是_________,若在圆底烧瓶中放入1.0g锌,选用量气管的适宜规格是(按标况计算)_____ (填字母序号)。
A.200mL B.300mL C.400mL D.500mL
(2)按上图连接好装置后,检查A装置气密性的操作是____,为使仪器a中的硫酸顺利加入圆底烧瓶,应_____并旋转活塞。
(3)实验发现:1.0g锌完全溶解后氢氧化钠洗气瓶增重0.8g,写出圆底烧瓶中发生反应的化学方程式:_________________。
(4)若ag锌与cmol/L的硫酸VL充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中, ![]() =______(用含字母的代数式表示), 若撤走B装置,
=______(用含字母的代数式表示), 若撤走B装置, ![]() 的数值将______(填“偏大”、“偏小”或“无影响”),其原因是________________。
的数值将______(填“偏大”、“偏小”或“无影响”),其原因是________________。
(5)为准确测量气体体积,量气管在读数时应注意的操作有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某溶液由Na+、CO32-、SO42-、Ca2+、Cl- 中的几种离子组成,现进行如下实验:
①取5mL待测液分成两份;
②第一份滴加BaCl2溶液,有白色沉淀产生,再加过量稀HNO3,沉淀全部溶解;
③第二份滴加AgNO3溶液,有白色沉淀产生,再加过量稀HNO3,沉淀部分溶解,同时有无色无味的气体产生。
回答下列问题:
(1)该溶液中一定含有的离子有_________________;一定不含有的离子有____________________。
(2)写出②中白色沉淀溶解的离子方程式___________________________________。
(二)①一定温度下,向体积相同的三个密闭容器中,分别充入CH4、O2、O3,测得容器内气体密度均相同,则三个容器中气体压强之比为P(CH4):P(O2):P(O3)=_____________________。
②标准状况下,1体积的水溶解500体积的HCl气体,若所得溶液密度为1.19g/cm3,则所得盐酸溶液的物质的量浓度为_____________mol/L(保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com