
【题目】A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为__________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为__________。
(3)C、D、E元素的第一电离能由大到小的顺序是__________。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是__________,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________。
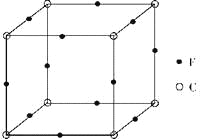
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为_____________,C离子的配位数是_____________。
【答案】1s22s22p63s23p63d9 平面三角形 N>O>S H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律,H2O2难溶于CS2 H2O2+CN-+OH-=CO32-+NH3 NaNO2 Cu3N 6
【解析】
A、B、C、D、E、F是原子序数依次递增的前四周期元素,A是宇宙中含量最丰富的元素,所以A是H元素;D与E同主族,且E的原子序数是D的两倍,所以D为O,E为S;B与D组成的化合物是一种温室气体,温室气体是CO2,则B为C;C元素原子最外层P能级比S能级多1个电子,则C为N;F原子的最外层电子数与A相同,其余各层均充满,则F为Cu。
(1)F为Cu,Cu2+的核外电子排布式为1s22s22p63s23p63d9;
(2)E为S,其具有强还原性的氧化物分子是SO2,VSEPR理论:价层电子对=3,成键电子对=2,孤电子对=1,基本构型为三角形,其中孤电子对占据一个顶点,分子构型为V形;
(3)同周期元素,第一电离能从左到右逐渐增大,但N原子的P轨道处于半充满状态,比相邻元素的第一电离能都大,同主族的第一电离能从上到下逐渐减小,所以S、N、O第一电离能由大到小的顺序是N>O>S;
(4)H2O2难溶于CS2的理由是H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律,H2O2难溶于CS2,H2O2能将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-=CO32-+NH3;
(5)在N的氧化物中,NO的相对分子质量最小,体积和物质的量成正比,NO和氧气4:1反应生成NO2,根据2NO+O2=2NO2所以得到等物质的量的NO2和NO的混合物,根据NO2+NO+2NaOH=2NaNO2+H2O,所生成的含氧酸盐的化学式是NaNO2;
(6)该晶胞中Cu原子的个数为12×1/4=3,N原子的个数为8×1/8=1,该化合物的化学式为Cu3N,N离子位于晶胞的顶点,Cu位于晶胞的棱上,所以N离子的配位数是8×3×1/4=6。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO![]()
B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO![]()
C.使甲基橙变红色的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH![]() 、SO
、SO![]() 、HCO
、HCO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法不正确的是
与pH的关系如图所示。下列说法不正确的是![]()
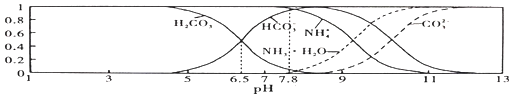
A.常温下![]()
B.向![]() 的上述溶液中逐滴滴加NaOH溶液时,
的上述溶液中逐滴滴加NaOH溶液时,![]() 和
和![]() 浓度都逐渐减小
浓度都逐渐减小
C.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
D.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中站有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔。请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为 ______。
② CaC2中C22-与O22+互为等电子体,1mol O22+中含有的![]() 键数目为 ______。
键数目为 ______。
③乙炔与氢氰酸反应可得丙烯睛(H2C=CH-C≡N),丙烯腈分子中碳原子轨道杂化类型是 ______,构成丙烯腈元素中第一电离能最大的是 ______。
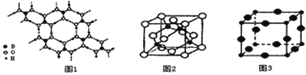
(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1)则1molH3BO3的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______。
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示(黑点代表铜原子,空心圆代表M原子)。
![]() 该晶体化学式为 ______。
该晶体化学式为 ______。
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
(4)Cu3N的晶胞结构如上图3,N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______gcm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。

下列说法中正确的是
A. 水的电离程度:M>N=Q>P
B. 图中M、P、Q三点对应溶液中![]() 相等
相等
C. N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
D. P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉和油脂为原料,制备生活中某些物质。
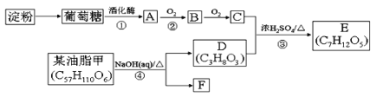
请回答下列问题:
(1)淀粉的分子式为____。
(2)③的反应类型___。
(3)写出反应①的化学方程式:____。写出反应④的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含![]() 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
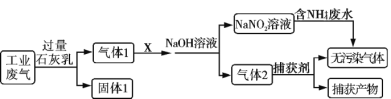
下列说法不正确的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X 可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含![]() 废水时,发生反应的离子方程式为:
废水时,发生反应的离子方程式为:![]() +
+![]()
![]() N2↑+2H2O
N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
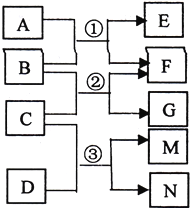
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com