
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法不正确的是
与pH的关系如图所示。下列说法不正确的是![]()
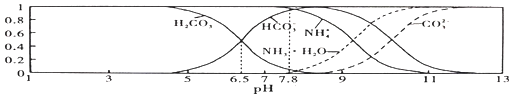
A.常温下![]()
B.向![]() 的上述溶液中逐滴滴加NaOH溶液时,
的上述溶液中逐滴滴加NaOH溶液时,![]() 和
和![]() 浓度都逐渐减小
浓度都逐渐减小
C.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
D.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图,下列叙述不正确的是( )
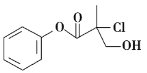
A.有机物A含有3种官能团
B.有机物A和NaOH的醇溶液共热可发生消去反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.有机物A能使溴水和酸性高锰酸钾溶液均褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素,请回答下列问题:
⑴基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
⑵Co能形成[Co(CNO)6]3-
①1 mol该离子中含有δ键的数目为________。
②与CNO-互为等电子体的分子为________(填化学式,任写一种)。
③相同压强下,CO晶体的熔点高于N2晶体的原因是________。
⑶氟硼酸铵(NH4BF4)用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等.是合成氮化硼纳米管的原料之一。
①1 mol NH4BF4含有_______ mol配位键。
②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为________(用元素符号表示)。
③BF4-的空间立体构型为________,其中硼原子的杂化轨道类型为________。
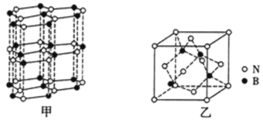
④BN晶体有多种结构,其中六方相氮化硼![]() 如图甲
如图甲![]() 是通常存在的稳定相,其结构与石墨相似却不导电,原因是_______,而立方氮化硼具有金刚石型结构,其晶胞如图乙所示,若晶胞参数为a pm,晶胞密度为d gcm-3,则阿伏加德罗常数的值可表示为________mol-1。
是通常存在的稳定相,其结构与石墨相似却不导电,原因是_______,而立方氮化硼具有金刚石型结构,其晶胞如图乙所示,若晶胞参数为a pm,晶胞密度为d gcm-3,则阿伏加德罗常数的值可表示为________mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据![]() 科技日报
科技日报![]() 报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
请回答下列问题:
⑴在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该原子的外围电子排布式为____________。
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是___________(填元素符号)。
⑶铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为________________。
⑷常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①CH3OH、HCHO、 HCOOH的沸点分别为64.7℃、-195℃、100.8℃,其主要原因是____________________;
②CH4和HCHO比较,键角较大的是_________,该分子的空间构型为____________。
⑸配离子中受配体的影响,中心离子同能级d轨道的能量不同,人们把1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量称为d的分裂能,用符号![]() 表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”
表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”![]() ,理由是____________。
,理由是____________。
⑹钴晶胞和白铜(铜镍合金)晶胞如图所示。
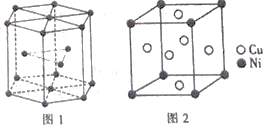
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dgcm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为____________pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值![]() 表示
表示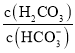 或
或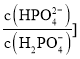 与pH的关系如图所示。已知碳酸
与pH的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]()
![]() 。则下列说法不正确的是( )
。则下列说法不正确的是( )
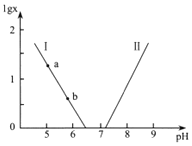
A.曲线Ⅱ表示 与pH的变化关系
与pH的变化关系
B.![]() 的过程中,水的电离程度逐渐增大
的过程中,水的电离程度逐渐增大
C.当![]()
![]() 时,
时,![]()
D.当pH增大时,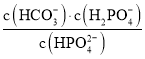 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)钠元素的焰色反应呈黄色,其中黄色对应的辐射波长为______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)C、H、N、O四种元素中电负性最大的是______![]() 填元素符号
填元素符号![]() ,写出Fe2+的最外层电子排布式______。根据等电子原理,写出CN-的电子式______,CNO-中心原子的杂化方式为______。
,写出Fe2+的最外层电子排布式______。根据等电子原理,写出CN-的电子式______,CNO-中心原子的杂化方式为______。
(3)![]() 的沸点比
的沸点比![]() ______
______![]() 填“高”或“低”
填“高”或“低”![]() ;原因是______。
;原因是______。
(4)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为______nm;MnO也属于NaCl型结构,晶胞参数为a’=0.448nm,则r(Mn2+)为______nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为__________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为__________。
(3)C、D、E元素的第一电离能由大到小的顺序是__________。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是__________,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________。
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为_____________,C离子的配位数是_____________。
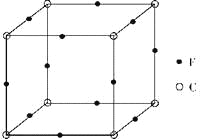
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是
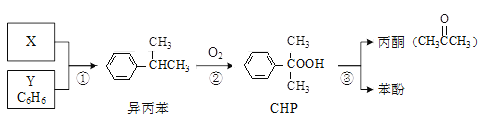
A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com