
【题目】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)钠元素的焰色反应呈黄色,其中黄色对应的辐射波长为______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)C、H、N、O四种元素中电负性最大的是______![]() 填元素符号
填元素符号![]() ,写出Fe2+的最外层电子排布式______。根据等电子原理,写出CN-的电子式______,CNO-中心原子的杂化方式为______。
,写出Fe2+的最外层电子排布式______。根据等电子原理,写出CN-的电子式______,CNO-中心原子的杂化方式为______。
(3)![]() 的沸点比
的沸点比![]() ______
______![]() 填“高”或“低”
填“高”或“低”![]() ;原因是______。
;原因是______。
(4)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为______nm;MnO也属于NaCl型结构,晶胞参数为a’=0.448nm,则r(Mn2+)为______nm。

【答案】C O 1s22s22p63s23p63d6 ![]() sp 高
sp 高 ![]() 形成分子间氢键,
形成分子间氢键,![]() 形成分子内氢键 0.148 0.076
形成分子内氢键 0.148 0.076
【解析】
(1)黄色对应的辐射波长范围是597-577nm,答案选C;
(2)同周期主族元素随着原子序数的增大,电负性增大,C、N、O在其氢化物中表现负化合价,电负性都大于H,因此电负性O>N>C>H,电负性最大的是O;Fe是26号元素,核外电子排布式为1s22s22p63s23p63d64s2,失去最外层的2个电子后形成Fe2+,因此Fe2+的核外电子排布式为1s22s22p63s23p63d6;CN-与N2互为等电子体,化学键相似,因此CN-的电子式为:![]() ;CNO-与CO2互为等电子体,空间构型相同,为直线型,中心C原子为sp杂化;
;CNO-与CO2互为等电子体,空间构型相同,为直线型,中心C原子为sp杂化;
(3))![]() 分子之间形成氢键,
分子之间形成氢键,![]() 分子内含有氢键,因此
分子内含有氢键,因此![]() 的沸点比
的沸点比![]() 的高;
的高;
(4)MgO中O2-离子采用面心立方最密堆积方式,晶胞面对角线上的O2-离子紧邻,2个O2-核间距(即2个O2-半径之和)等于晶胞棱长的![]() ,因此r(O2-)=0.420nm×
,因此r(O2-)=0.420nm×![]() ×
×![]() =0.148nm,晶胞棱长=2r(O2-)+2r(Mn2+)=0.448nm,因此r(Mn2+)=
=0.148nm,晶胞棱长=2r(O2-)+2r(Mn2+)=0.448nm,因此r(Mn2+)=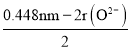 =0.076nm。
=0.076nm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】![]() 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
化学式 |
|
| HClO |
电离平衡常数 |
|
|
|
回答下列问题:
(1)一般情况下,当温度升高时,![]() ______填“增大”、“减小”或“不变”。
______填“增大”、“减小”或“不变”。
(2)下列四种离子结合质子能力由大到小的顺序是______填序号;
a、CO32- b、ClO- c、CH3COO- d、HCO3-
(3)下列反应不能发生的是______填序号
a. ![]()
b. ![]()
c. ![]()
d. ![]()
(4)用蒸馏水稀释![]() 的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
a. 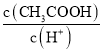 b.
b. ![]() c.
c.![]() d.
d.![]()
(5)体积均为10mLpH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
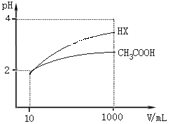
则HX的电离平衡常数______填“大于”、“等于”或“小于”,下同醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液中水电离出来的c(H+),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 说法正确的是( )
说法正确的是( )
A.同一条直线上碳原子有6个
B.所有原子可能在同一平面上
C.同一平面上的原子最多有19个
D.所有碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法不正确的是
与pH的关系如图所示。下列说法不正确的是![]()
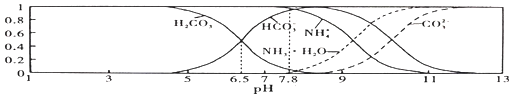
A.常温下![]()
B.向![]() 的上述溶液中逐滴滴加NaOH溶液时,
的上述溶液中逐滴滴加NaOH溶液时,![]() 和
和![]() 浓度都逐渐减小
浓度都逐渐减小
C.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
D.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在适宜的条件下反应,其中氧化剂与还原剂的物质的量之比为2:1的是( )
A. ![]()
B. Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
C. CaH2+2H2O===Ca(OH)2+2H2↑
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中站有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔。请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为 ______。
② CaC2中C22-与O22+互为等电子体,1mol O22+中含有的![]() 键数目为 ______。
键数目为 ______。
③乙炔与氢氰酸反应可得丙烯睛(H2C=CH-C≡N),丙烯腈分子中碳原子轨道杂化类型是 ______,构成丙烯腈元素中第一电离能最大的是 ______。
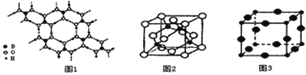
(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1)则1molH3BO3的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______。
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示(黑点代表铜原子,空心圆代表M原子)。
![]() 该晶体化学式为 ______。
该晶体化学式为 ______。
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
(4)Cu3N的晶胞结构如上图3,N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______gcm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。

下列说法中正确的是
A. 水的电离程度:M>N=Q>P
B. 图中M、P、Q三点对应溶液中![]() 相等
相等
C. N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
D. P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉和油脂为原料,制备生活中某些物质。
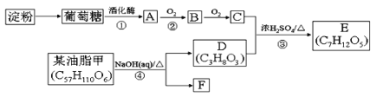
请回答下列问题:
(1)淀粉的分子式为____。
(2)③的反应类型___。
(3)写出反应①的化学方程式:____。写出反应④的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨属于空气污染物,二氧化硫(![]() )的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降到热电厂附近的雨水进行实验。
)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降到热电厂附近的雨水进行实验。
a.测得该雨水样品的![]() 为4.73;
为4.73;
b.向雨水样品中滴加![]() 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
c.每隔1h,通过![]() 计测定雨水样品的
计测定雨水样品的![]() ,测得的结果如下表:
,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题。
(1)正常雨水的![]() 为5.6,偏酸性,这是因为________。
为5.6,偏酸性,这是因为________。
(2)分析上述数据变化,你认为形成这一变化的原因是_________。
(3)该兴趣小组同学取某一时段的这种雨水VL,加入![]() 的
的![]() 溶液至不再产生沉淀时,恰好消耗
溶液至不再产生沉淀时,恰好消耗![]()
![]() 溶液。请计算:
溶液。请计算:
①该VL雨水中溶解![]() 的体积(标准状况)为_______。
的体积(标准状况)为_______。
②生成沉淀物的质量m的范围为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com