
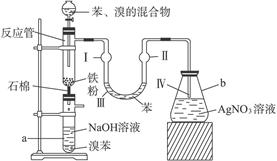
科目:高中化学 来源:不详 题型:填空题
| 编号 | 电极材料 | 电解质溶液 | 电流指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.1.0 mol·L-1HNO3 | B.1.0 mol·L-1盐酸 | C.1.0 mol·L-1 NaOH | D.3%H2O2(E)、 0.1mol·L-1KI(F)、 0.1 mol·L-1CuSO4(G)、 20%KSCN(H)、澄清石灰水(I)、氧化铜(J)、蒸馏水(K)。 |
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 | 固体产物部分溶解 |
| 步骤2:向试管中加入适量硫酸铜溶液,再加入少量将步骤1中的不溶固体,充分振荡 | (1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设 成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体生成.则证明有 存在。 |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN | 结合步骤2中的(2): (1)若溶液基本无色,则假设(1)成立 (2)若 ,则假设 成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.检验自来水中含有Cl- | B.检验鸡蛋壳中含有碳酸盐 |
| C.检验加碘食盐中加的不是碘单质 | D.除去热水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
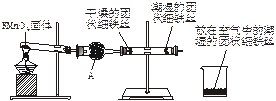
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶中有少量水 |
| B.有少量KOH残留在烧杯中 |
| C.定容时俯视 |
| D.定容时仰视 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
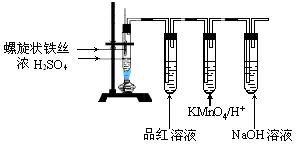
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com