
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:
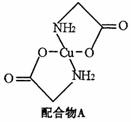
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有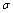 键的数目为 。
键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
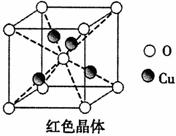
则该化合物的化学式是 。
【答案】(1)3d104s1;(2)N>O>C;(3)sp2、sp3;(4)8NA;(5)N2O(或SCN-、N3-等);(6)Cu2O。
【解析】
试题分析:(1)29号元素Cu在基态原子的外围电子排布式为3d104s1;(2)一般情况下同一周期的元素,原子序数越大,元素的第一电离能也越大,但是由于N元素的原子的最外层的电子处于该轨道的半充满的稳定状态,所以电子比原子序数大1 的O元素还大。所以元素C、N、O的第一电离能由大到小排列顺序为N>O>C;在硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A,配合物A中碳原子就是H2N-CH2-COONa中的C原子,其轨道杂化类型为sp2、sp3;(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有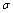 键的数目为8NA;(5)等电子体是微粒中含有的原子个数相同,最外层电子数也相同的物质。与二氧化碳等电子体的微粒是N2O(或SCN-、N3-等);(6)根据物质的晶体结构可知:在一个晶胞中含Cu:4;含有O:8×1/8+1=2,n(Cu):n(O)=42=21,所以化学式是Cu2O。
键的数目为8NA;(5)等电子体是微粒中含有的原子个数相同,最外层电子数也相同的物质。与二氧化碳等电子体的微粒是N2O(或SCN-、N3-等);(6)根据物质的晶体结构可知:在一个晶胞中含Cu:4;含有O:8×1/8+1=2,n(Cu):n(O)=42=21,所以化学式是Cu2O。
考点:考查元素原子的价电子排布式、元素电离能的比较、原子的杂化类型、等电子体、晶体的化学式的确定的知识。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1KNO3溶液:H+、Fe2+、SCN-、SO42-
B. 的溶液:K+、Ba2+、NO3-、Cl-
的溶液:K+、Ba2+、NO3-、Cl-
C.pH=0的溶液:Al3+、Cl-、SO42-、CO32-
D.c(ClO-) = 1.0 mol·L-1的溶液:Na+、I-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2L的密闭容器中加入4mol A和2mol B进行如下反应:3A(g)+2B(g)⇌4C(s)+D(g),反应2min后达到平衡,测得生成1.6mol C,下列说法正确的是( )
|
| A. | 前2 min D的平均反应速率为0.2 mol•L﹣1•min﹣1 |
|
| B. | 此时,B的平衡转化率是40% |
|
| C. | 增大该体系的压强,平衡不移动 |
|
| D. | 增加B,平衡向右移动,B的平衡转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是
A.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O → C6H5OH+HCO3-
B.AlCl3溶液中加入少量氨水:Al3++3OH- = Al(OH)3↓
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH- = Fe(OH)2↓
D.用惰性电极电解氯化钠溶液:2Cl-+2H+ 通电 H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B.pH =11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)> c(OH-)>c(H+)
C.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) = 0.1 mol·L-1
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性 c(CH3COO-)>c(Cl-)
>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
纯碱和小苏打是厨房中两种常见用品,下列区分它们的做法正确的是 ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,火焰颜色发生明显变化的是小苏打
C.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
D.用两只玻璃杯分别加入少量的两种样品,再加入等量的食醋,产生气泡速度快的是小苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是( )
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液
④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小
D.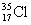 与
与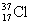 得电子能力相同
得电子能力相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com