
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小
D.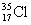 与
与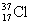 得电子能力相同
得电子能力相同
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
Ⅰ 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2+6C+2N2 Si3N4+6CO;DH <0。
Si3N4+6CO;DH <0。
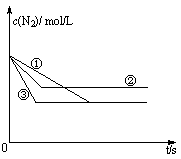 (1)在容积固定的密闭容器中,分别在三种不同的实验条件下进行上述制备反应,测得N2的物质的量浓度随时间的变化如右图所示,②和③分别仅改变一种反应条件。所改变的条件分别是:② ;③ 。
(1)在容积固定的密闭容器中,分别在三种不同的实验条件下进行上述制备反应,测得N2的物质的量浓度随时间的变化如右图所示,②和③分别仅改变一种反应条件。所改变的条件分别是:② ;③ 。
(2)1 000℃时,在2 L密闭容器中进行上述反应,若起始时N2浓度为4.0 mol/L,经1小时反应达到平衡状态,此时容器内气体总浓度为10.0 mol/L,则以CO表示的反应速率为 。若某时刻测得N2和CO的浓度均为6.0 mol/L,则反应的V正 V逆(填“大于”、“小于”、 “等于”)。
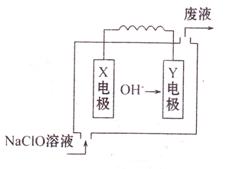
Ⅱ、右图为Mg—NaClO燃料电池结构示意图。已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极。
Y电极材料为 。
X电极发生的电极反应式为 。
若该电池开始时加入1L 0.2mol/L的NaOH溶液,然后从下口充入1L 0.1mol/L的NaClO溶液(忽略整个过程的体积变化),当NaClO完全放电时溶液的PH=
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:
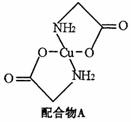
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有 键的数目为 。
键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
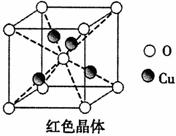
则该化合物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3 + 7O2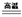 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
(2)2Na2CrO4 + H2SO4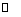 Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法正确的是( )
A.反应(1)和(2)均为氧化还原反应
B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D.反应(1)中每生成1molNa2CrO4时电子转移3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列物质的化学性质,判断其应用错误的是
A.酒精能使蛋白质变性,可用于杀菌消毒
B.CaO能与SO2反应,可作工业废气的脱硫剂
C.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
D.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素X核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关X的说法中,不正确的是
A.X能形成化学式为X(OH)3的碱
B.X能形成化学式为NaXO3的含氧酸钠盐
C.X原子的最外层电子数和核电荷数不可能为偶数
D.X能与某些金属元素或非金属元素形成化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质。已知:甲+乙=丁+辛,
甲+丙=戊+辛;常温下0.1 mol/L 丁溶液的pH为13。下列说法正确的是
A.元素B在周期表中的位置为第二周期第VIA族
B.元素B、C、D的原子半径由大到小的顺序为r (D)>r(C)>r(B)
C.1.0 L、0. 1 mol/L戊溶液中阴离子总的物质的量小于0. 1 mol
D.1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.直径介于1~10 nm之间的粒子称为胶体
B.Fe(OH)3胶体是纯净物
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子不可以透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1) 工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
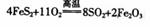 ,该反应中被氧化的元素是 (填元素符号)。
,该反应中被氧化的元素是 (填元素符号)。
当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2) 实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)

①:实验过程中,需要通入氧气。试写出一个用右侧图所示装置制取氧气的化学方程式
。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
。
 ③实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
③实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
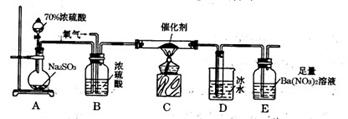
(3) 某学习小组设计用如下图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为
。
②为验证二氧化硫的还原性,充分反应后取试管b中的溶液分成三份,
分别进行如下实验: 方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”); 试管b中发生反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com