
【题目】下列离子的VSEPR模型与其立体构型一致的是( )
A. SO![]() B. ClO
B. ClO![]() C. NO
C. NO![]() D. ClO
D. ClO![]()
【答案】B
【解析】A.SO32-中价层电子对个数=3+![]() ×(6+2-3×2)=4且含有一个孤电子对,所以VSEPR模型为四面体结构,实际为三角锥形结构,故A错误;B.ClO4-中价层电子对个数=4+
×(6+2-3×2)=4且含有一个孤电子对,所以VSEPR模型为四面体结构,实际为三角锥形结构,故A错误;B.ClO4-中价层电子对个数=4+![]() ×(7+1-4×2)=4且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是平面三角形结构,故B正确;C.NO2-中价层电子对个数=2+
×(7+1-4×2)=4且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是平面三角形结构,故B正确;C.NO2-中价层电子对个数=2+![]() ×(5+1-2×2)=3且含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,故C错误;D.ClO3-中价层电子对个数=3+
×(5+1-2×2)=3且含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,故C错误;D.ClO3-中价层电子对个数=3+![]() ×(7+1-3×2)=4且含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,故D错误;故选B。
×(7+1-3×2)=4且含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,故D错误;故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列括号中的分离方法运用得当的是( )
A.植物油和水(蒸馏)
B.水溶液中的食盐和碘(分液)
C.CaCO3和CaCl2(溶解、过滤、蒸发)
D.自来水中的杂质(萃取)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是
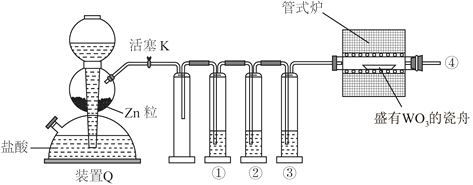
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理____________,哪些违反了洪特规则_______________。哪些既没有违反泡利原理又没有违反洪特规则_______________。

(Ⅱ)等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的分子中,互为等电子体的是:______和______;______和______.
(2)此后,等电子原理又有所发展.例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:______、______.
查看答案和解析>>
科目:高中化学 来源: 题型:
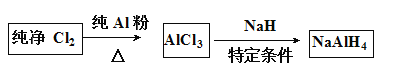
【题目】铝氢化钠(NaAIH4)是有机合成的重要还原剂,其合成线路如下图所示。
已知AlCl3的熔点为190℃,沸点为178℃,在潮湿的空气中易水解。某实验小组利用下图中装置制备无水AlC13。
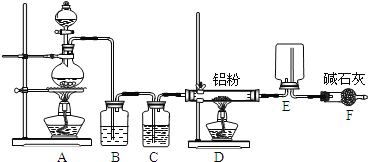
(1)①写出圆底烧瓶中发生反应的离子方程式______。
②装置F的作用是 ________。
(2)AlCl3与NaH反应时,需将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的可能原因是 ________。
(3)利用铝氢化钠遇水反应生成的氢气的体积测定铝氢化钠样品纯度。
①其反应的化学方程式为 ______ 。
②设计如下四种装置测定铝氢化钠样品的纯度(杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是 ______(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 强酸性溶液中:K+、Cu2+、NO3-
B. 强碱性溶液中:Na+、NH4+、Cl-
C. 含1 mol·L-1 NH3·H2O的溶液中:K+、Al3+、SO42-
D. 含1 mol·L-1 Fe3+的溶液中:H+、Na+、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。A和B分别是( )
A.硅原子和钠原子
B.硼原子和氦原子
C.氯原子和碳原子
D.碳原子和铝原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
 (2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。

(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响____________________,给出合理的解释:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第________周期第______族,它的一种核素可测定文物年代,这种元素的符号是________。
(2)元素Y的原子结构示意图为________,其与氢元素形成一种离子YH![]() .该离子符号是________。
.该离子符号是________。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),
下列表述中能证明这一事实的是______(填字母)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是________,理由是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com