
【题目】镁铝合金5.1 g溶于300 mL2 mol·L-1盐酸中,标准状况下放出气体的体积为5.6 L,向反应后的溶液中加入500 mLNaOH溶液充分反应,最终产生白色沉淀。下列有关说法不正确的是
A.5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g
B.溶解5.1 g镁铝合金时,剩余盐酸中溶质的物质的量为0.1 mol
C.若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol·L-1
D.生成白色沉淀的最大质量为13.6 g
【答案】C
【解析】
Mg、Al与HCl发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,5.6 L气体是H2,该H2的物质的量n(H2)=![]() =0.25 mol,故根据H元素守恒可知参加反应的HCl的物质的量n(HCl)=0.25 mol×2=0.5 mol,溶液中n(HCl)总=2 mol/L×0.3 L=0.6 mol,大于参加反应的HCl的物质的量,故金属完全反应。向反应后溶液中加入一定量烧碱溶液,生成沉淀的质量最大,则Mg2+、Al3+恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),根据电子守恒计算n(OH-),再根据m=n·M计算m(OH-)。
=0.25 mol,故根据H元素守恒可知参加反应的HCl的物质的量n(HCl)=0.25 mol×2=0.5 mol,溶液中n(HCl)总=2 mol/L×0.3 L=0.6 mol,大于参加反应的HCl的物质的量,故金属完全反应。向反应后溶液中加入一定量烧碱溶液,生成沉淀的质量最大,则Mg2+、Al3+恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),根据电子守恒计算n(OH-),再根据m=n·M计算m(OH-)。
A.假设镁、铝的物质的量分别为x mol、y mol,根据电子守恒可得2x+3y=0.25×2 mol;根据金属质量关系可得:24x+27y=5.1 g,解得x=0.1 mol,y=0.1 mol,所以金属Mg的质量为m(Mg)=0.1 mol×24 g/mol=2.4 g,金属Al的质量m(Al)= 0.1 mol×27 g/mol=2.7 g,A正确;
B.n(H2)=![]() =0.25 mol,故参加反应的HCl的物质的量n(HCl)反应=0.25 mol×2=0.5 mol,300 mL2 mol·L-1盐酸中HCl的物质的量溶液中n(HCl)总=2 mol/L×0.3 L=0.6 mol,所以剩余盐酸的物质的量n(HCl)剩余=0.6 mol -0.5 mol=0.1 mol,B正确;
=0.25 mol,故参加反应的HCl的物质的量n(HCl)反应=0.25 mol×2=0.5 mol,300 mL2 mol·L-1盐酸中HCl的物质的量溶液中n(HCl)总=2 mol/L×0.3 L=0.6 mol,所以剩余盐酸的物质的量n(HCl)剩余=0.6 mol -0.5 mol=0.1 mol,B正确;
C.若镁离子和铝离子完全转化为白色沉淀,此时沉淀的质量最大,溶液为NaCl溶液,溶质为NaCl,根据钠元素守恒可知,n(NaOH)=n(NaCl)=n(HCl)=0.6 mol,则该NaOH溶液的物质的量浓度c(NaOH)=![]() =1.2 mol/L。若白色沉淀只有Mg(OH)2,则需要把氢氧化铝溶解,因此NaOH溶液的物质的量浓度一定大于1.2 mol/L,C错误;
=1.2 mol/L。若白色沉淀只有Mg(OH)2,则需要把氢氧化铝溶解,因此NaOH溶液的物质的量浓度一定大于1.2 mol/L,C错误;
D.根据电子注意守恒可知n(OH-)=2n(H2)=2×0.25 mol=0.5 mol,则反应产生沉淀的最大质量为m(沉淀)=m[Mg(OH)2]+m[Al(OH)3]=m(Mg)+m(Al)+m(OH-)=5.1 g+0.5 mol×17 g/mol=13.6 g,D正确;
故合理选项是C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:溴苯的沸点为156℃,苯的沸点为80℃。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图:
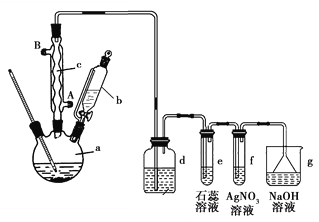
按以下要求回答问题:
(1)冷凝管的进水口为______(填“A”或“B”);冷凝管的作用:__________。
(2)d中盛放的试剂是_____________
(3)有同学认为苯与溴的反应为加成反应而不是取代反应,请根据该实验装置特点和实验现象判断反应的类型。
①反应类型:_______________(填“加成反应”或“取代反应”);
②叙述得出这一结论的实验现象:____________________________________。
(4)分离提纯:
①反应后a瓶中的溴苯中因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴可加入___________溶液,振荡,再通过____________(填分离方法)分离提纯;
②苯与溴还可能发生副反应生成对二溴苯(沸点220℃)和邻二溴苯(沸点224℃,因此最后再经____________(填分离方法)即可得到较纯净的溴苯,该过程中为了受热均匀和易于控制温度,可采用_____________(填“水浴”或“油浴”)加热。
(5)检验鉴别:充分反应后,三颈烧瓶中的粗产品经水洗、分液后得到水洗液,为验证水洗液中是否存在Fe3+不能选用的试剂是_________(填字母)
A.NaOH溶液 B.AgNO3溶液 C.KSCN溶液 D.苯酚溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙烯,常因温度过高生成少量SO2,有人设计了如图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
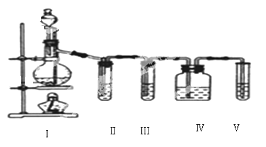
(1)在烧瓶中除了加入乙醇、浓硫酸外,还应放入几块碎瓷片,其目的是:____。
(2)写出生成乙烯的反应方程式:____。
(3)Ⅱ、Ⅲ、Ⅳ、Ⅴ、装置中盛放的试剂是(从下列所给试剂中选出,填序号)
①品红溶液,②NaOH溶液,③酸性KMnO4溶液。则正确的排列顺序为:_____。
(4)能说明SO2气体存在的现象是____。
(5)确证含有乙烯的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z原子序数依次增大,甲、乙、丙、丁、戊、己是由这些元素构成的物质。常温下,丙和戊是单质气体,乙为生活中常见的无色液体,戊能使带火星的木条复燃,0.01mol/L丁溶液pH=12,上述物质的转化关系如图所示.下面说法正确的是
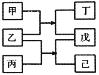
A.原子半径:X<Y<ZB.单质沸点:W>X
C.气态氢化物的热稳定性:X>YD.Y和Z形成的化合物溶于水显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表情包、斗图是新媒体时代的产物,微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列有关说法正确的是( )

A. A 物质与 D 物质互为同系物
B. 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
C. B 物质是由的1mol 苯与3mol 氯气在光照的条件下发生取代反应而制备得到的
D. C 物质是苯的同系物,其二溴代物有7 种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物研究
![]() 和
和![]() 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇:![]() ,现在体积为1L的恒容密闭容器
,现在体积为1L的恒容密闭容器![]() 图甲
图甲![]() 中通入1molCO和
中通入1molCO和![]() ,测定不同时间、不同温度
,测定不同时间、不同温度![]() 下容器中CO的物质的量,如表:
下容器中CO的物质的量,如表:

0min | 10min | 20min | 30min | 40min | |
| 1mol |
|
|
|
|
| 1mol |
|
| a | a |
请回答:
![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() ,理由是______。已知
,理由是______。已知![]() 时,第20min时容器内压强不再改变,此时
时,第20min时容器内压强不再改变,此时![]() 的转化率为______,该温度下的化学平衡常数为______。
的转化率为______,该温度下的化学平衡常数为______。
![]() 若将1molCO和
若将1molCO和![]() 通入原体积为1L的恒压密闭容器
通入原体积为1L的恒压密闭容器![]() 图3乙
图3乙![]() 中,在
中,在![]() 下达到平衡,此时反应的平衡常数为______;若再向容器中通入
下达到平衡,此时反应的平衡常数为______;若再向容器中通入![]() ,重新达到平衡后,
,重新达到平衡后,![]() 在体系中的百分含量______
在体系中的百分含量______![]() 填“变大”或“变小”或“不变”
填“变大”或“变小”或“不变”![]() 。
。
![]() 一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入
一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入![]() NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液
NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液![]() 假设溶液体积不变
假设溶液体积不变![]() ,测得溶液中
,测得溶液中![]() ,则该混合溶液中甲酸的电离平衡常数
,则该混合溶液中甲酸的电离平衡常数![]() ______
______![]() 用含a和b的代数式表示
用含a和b的代数式表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的电池,总反应为: 3Zn+2FeO42-+8H2O=2Fe(OH)3↓+3Zn(OH)2↓+4OH—,其工作原理如图所示。下列说法不正确的是
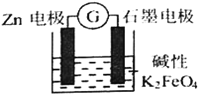
A. Zn极是负极,发生氧化反应
B. 随着反应的进行,溶液的pH增大
C. 电子由Zn极流出到石墨电极,再经过溶液回到Zn极,形成回路
D. 石墨电极上发生的反应为:FeO42—+3e—+4H2O=Fe(OH)3↓+5OH—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com