
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
A.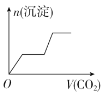 B.
B.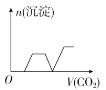 C.
C.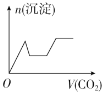 D.
D.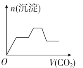
【答案】D
【解析】
将二氧化碳气体通入含有氢氧化钾,氢氧化钡,KAlO2的混合溶液中,生成沉淀的量和通入二氧化碳的量的关系以二氧化碳的体积为横坐标,以沉淀的物质的量为纵坐标的图象的画法,可以做如下
CO2先与Ba(OH)2反应(有沉淀BaCO3生成),当Ba(OH)2消耗完毕后再与KOH反应(此时无沉淀);最后与KAlO2反应(有沉淀Al(OH)3生成),
以上过程中图形应是:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成];
过量的CO2还可以继续与K2CO3反应得到KHCO3,继续过量的CO2还可以使BaCO3沉淀溶解,最后是Al(OH)3沉淀,
所以接着的图形应该为:平台,沉淀(BaCO3)减少,平台,
故整个过程的图形应为:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成],平台,沉淀(BaCO3)减少,平台,满足以上关系的图象为D,
故选:D。


科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
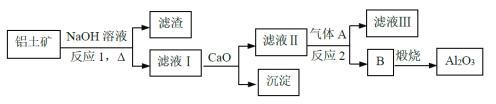
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
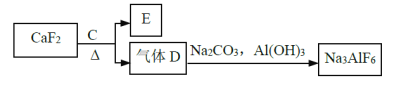
请回答下列问题:
(1)反应1中的化学方程式有2NaOH+SiO2→Na2SiO3+H2O以及___________;
(2)滤液Ⅰ中加入CaO生成的沉淀是_______,反应2的离子方程式为________(气体A过量);
(3)E可作为建筑材料,化合物C是浓硫酸,请写出由D制备冰晶石的化学方程式______;
(4)电解制铝以石墨为电极,请写出阳极的电极反应式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液 , 根据图示判断,下列说法正确的是( )

A. H2A在水中的电离方程式是:H2A===H++HA-;HA-![]() H++A2-
H++A2-
B. 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下二者完全反应,只得到CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4g,碱石灰增重4.4g,剩余气体在标准状况下的体积为2.24L,回答下列问题:
(1)写出有机化合物A的分子式___(要求写出推理过程)。
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或实验现象的解释(方程式)正确的是
A.除去Na2CO3溶液中的Na2SO4,加入适量Ba(OH)2溶液后,过滤:Ba2++![]() =BaSO4↓
=BaSO4↓
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2=Ag2S↓+2Cl
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀: 2![]() +Ca2++2OH=CaCO3↓+
+Ca2++2OH=CaCO3↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对离子化合物的叙述正确的是( )
![]() 离子化合物一定是含有离子键的化合物
离子化合物一定是含有离子键的化合物
![]() 离子化合物一定是由金属元素和非金属元素组成
离子化合物一定是由金属元素和非金属元素组成
![]() 离子化合物熔点高,加热一定难分解
离子化合物熔点高,加热一定难分解
![]() 化合物在液态时导电的是离子化合物,不导电的是共价化物
化合物在液态时导电的是离子化合物,不导电的是共价化物
A. ①④B. ②③C. ①④②③D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列原子或原子团,请按要求选择两个,写出符合要求的有机物的结构简式:﹣CH3、﹣OH、﹣CHO、﹣COOH、﹣Br、﹣H、﹣CH2CH3、![]()
(l)分子结构为正四面体的是:___;
(2)能使FeCl3溶液显紫色的是:___;
(3)在NaOH乙醇溶液中能发生消去反应的是:____;
(4)1mol该有机物与足量的银氨溶液反应,有4molAg生成的是:___;
(5)相对分子质量是60,能和NaHCO3反应放出CO2的是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金5.1 g溶于300 mL2 mol·L-1盐酸中,标准状况下放出气体的体积为5.6 L,向反应后的溶液中加入500 mLNaOH溶液充分反应,最终产生白色沉淀。下列有关说法不正确的是
A.5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g
B.溶解5.1 g镁铝合金时,剩余盐酸中溶质的物质的量为0.1 mol
C.若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol·L-1
D.生成白色沉淀的最大质量为13.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中发生的一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,则转移__________mol电子。
6SO2+Fe3O4,若有3molFeS2参加反应,则转移__________mol电子。
(2)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为__________。从腐蚀废液中回收金属铜需要的试剂是__________。
(3)与明矾相似,硫酸铁也可用于净水,其作用原理是____________(用离子方程式表示);在使用时发现硫酸铁并不能使酸性废水中悬浮物沉降除去,其原因是__________。
(4)钢铁的电化学腐蚀简单示意图如图所示,发生吸氧腐蚀时,负极名称为________;正极的电极反应式为________;
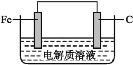
(5)铁红是一种红色颜料,其主要成分是Fe2O3。将一定量的铁红溶于160mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com