
【题目】(1)标准状况下,0.2mol NH3与_________________g H2O的电子数相等。
(2)含有相同氧原子数的CO和CO2,其质量比为_________________________。
(3)已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的摩尔质量__________。
(4)已知V mLAl2(SO4)3溶液中含Al3+ a g,则溶液中SO42-的物质的量浓度是_____________。
(5)下列8种化学符号:11H2、12H2、614C、36Li、1123Na、714N、37Li、1224Mg。
①表示核素的符号共________种。
②互为同位素的是________。
③中子数相等,但质子数不相等的核素是_______________。
【答案】3.6 14:11 72g·mol-1 ![]() mol·L-1 6 36Li、37Li 1123Na、1224Mg
mol·L-1 6 36Li、37Li 1123Na、1224Mg
【解析】
(1)NH3含有10个电子,则0.2mol NH3含有2mol电子,H2O分子含有10个电子,则0.2mol水与0.2mol氨气含有的电子数相等,则m(H2O)=0.2mol×18·mol-1=3.6,故答案为:3.6;
(2)含有相同氧原子数的CO和CO2,二者的物质的量为2:1,质量比为2×28:44=14:11,故答案为:14:11;
(3)已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的质量为14g+40g-38g=18g,则C的摩尔质量为![]() =72g·mol-1,故答案为:72g·mol-1;
=72g·mol-1,故答案为:72g·mol-1;
(4)n(Al3+)=![]() mol,则n(SO42-)=
mol,则n(SO42-)=![]() mol×
mol×![]() =
=![]() mol,则溶液中SO42-的物质的量浓度是
mol,则溶液中SO42-的物质的量浓度是 =
=![]() mol·L-1,故答案为:
mol·L-1,故答案为:![]() mol·L-1。
mol·L-1。
(5)①表示核素的符号有614C、36Li、1123Na、714N、37Li、1224Mg共6种。
②质子数为3,中子数分别为3和4,互为同位素的是36Li、37Li。
③中子数相等,但质子数不相等的核素是1123Na、1224Mg,中子数相等12,但质子数分别为11、12。
故答案为:6;36Li、37Li;1123Na、1224Mg。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期元素。n、p、r是由这些元素组成的二元化合物。m 是元素W的单质。q是元素Y的单质且是制作太阳能电池的原料。p在常温下为常见无色液体,0.010mol·L-1的r溶液中c(H+)为0.010 mol·L-1,s是弱酸且不溶于水。上述物质的转化关系如图所示。下列说法不正确的是

A.r易溶于p
B.原子半径:Z<Y
C.最高价氧化物对应水化物的酸性:Y<Z
D.最简单氢化物的稳定性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
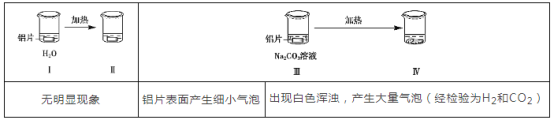
下列说法不正确的是( )
A. Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜
C. Ⅳ溶液中可能存在大量Al3+
D. 推测出现白色浑浊的可能原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成配平:
Fe2++ ClO-+ = Fe(OH)3↓+ C1-+
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。m、n、r为这些元素组成的化合物,常温下,0.1 mol·L-1 m溶液的pH=13,组成n的两种离子的电子层数相差1。p、q为其中两种元素形成的单质。上述物质的转化关系如图所示。下列说法正确的是 ( )
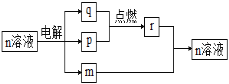
A. 原子半径:X<Y<Z<W
B. X、Z既不同周期也不同主族
C. 简单氢化物的沸点:Y<W
D. Y、Z、W形成的一种化合物具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如图所示:

(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“循环经济”和“低碳经济”是目前备受关注的课题,因而对碳和硫的化合物的综合利用成为研究的热点。请回答下列问题:
(1)下列事实中,不能用来比较碳元素和硫元素非金属性强弱的是______(填选项字母)。
A.![]() 有漂白性而
有漂白性而![]() 没有
没有
B.少量![]() 能与
能与![]() 反应生成
反应生成![]()
C.![]() 能使酸性
能使酸性![]() 溶液褪色而
溶液褪色而![]() 不能
不能
D.![]() 溶液显碱性而
溶液显碱性而![]() 溶液显中性
溶液显中性
(2)下图是通过热循环进行能源的综合利用和污染治理的反应系统原理。

系统(Ⅱ)制氢气的热化学方程式为_________;两个系统制得等量的H2所需能量较少的是________。
(3)向10 L恒容密闭容器中充入2 mol CO和1 mol ![]() ,发生反应2CO(g)+SO2 (g)
,发生反应2CO(g)+SO2 (g)![]() S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
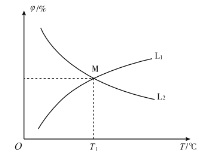
①图中能表示CO的平衡体积分数与温度关系的曲线为______(填“L1”或“L2”)。
②T1 ℃时,![]() 的平衡转化率α1=_______,反应的平衡常数
的平衡转化率α1=_______,反应的平衡常数![]() _________。
_________。
③只改变下列条件,既能加快该反应速率,又能增大CO的平衡转化率的是_____(填选项字母)。
A.增大压强 B.充入一定量![]()
C. 充入一定量![]() D.加入适当催化剂
D.加入适当催化剂
④向起始温度为![]() ℃的10 L绝热容器中充入2 mol CO和1 mol
℃的10 L绝热容器中充入2 mol CO和1 mol ![]() ,重复实验,该反应的平衡常数
,重复实验,该反应的平衡常数![]() _____
_____![]() (填“>”“<”或“=”),理由为_____。
(填“>”“<”或“=”),理由为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若![]() 与
与![]() 的电子层结构相同,且2个
的电子层结构相同,且2个![]() 原子与3个
原子与3个![]() 原子的电子总数相等,则下列说法正确的是
原子的电子总数相等,则下列说法正确的是
A. ![]() 为硫元素
为硫元素
B. ![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]()
C. ![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
D. ![]() 、
、![]() 都是元素周期表中
都是元素周期表中![]() 区的元素
区的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体X通入溶液A(如下图,尾气吸收装置略)中,实验现象能够支持结论的是
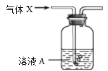
选项 | 气体X | 溶液A及反应现象 | 结论 |
A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
B. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
C. | 溴乙烷与氢氧化钠醇溶液共热生成的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
D. | 碳酸钠固体与醋酸溶液反应产生的气体 | 苯酚钠溶液中出现白色沉淀 | 碳酸的酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com