
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如图所示:

(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为______mol/L。
【答案】Zn 不是 Fe+2H+=Fe2++H2↑ 做氧化剂,将部分Fe2+氧化为Fe3+ 利用丁达尔效应 1.25
【解析】
废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,调节溶液PH生成氢氧化锌沉淀,过滤、洗涤、灼烧得到氧化锌,不溶物为铁,溶于稀硫酸加入适量过氧化氢,调节溶液PH=1~2,部分氧化亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,加热促进水解生成四氧化三铁胶体粒子。
(1)锌是两性金属能溶于酸或碱,而Fe只与酸反应,不与碱反应,则加入氢氧化钠,锌发生反应,故答案为:Zn;
(2)Zn(OH)2沉淀加热可得ZnO,元素化合价不变,为非氧化还原反应,故答案为:不是;
(3)不溶物为Fe,加入硫酸反应生成硫酸亚铁,反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)在酸性条件下,H2O2能将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:做氧化剂,将部分Fe2+氧化为Fe3+;
(5)胶体具有丁达尔效应,可用丁达尔效应检验胶体的生成,故答案为:利用丁达尔效应;
(6)n(H2SO4)=2n(H2SO4·SO3)=![]() ×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=
×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=![]() =1.25mol·L-1,
=1.25mol·L-1,
故答案为:1.25;


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】Fe(OH)3广泛应用于医药制剂、颜料制造等领域,其制备步骤及装置如下:在三颈烧瓶中加入16.7gFeSO4·7H2O和40.0ml蒸馏水。边搅拌边缓慢加入3.0mL浓H2SO4,再加入2.0gNaClO3固体。水浴加热至80℃,搅拌一段时间后,加入NaOH溶液,充分反应。经过滤、洗涤、干燥得产品。
(1)NaClO3氧化FeSO4·7H2O的离子方程式为_____________。
(2)加入浓硫酸的作用为_________(填标号)。
a.提供酸性环境,增强NaClO3氧化性 b.脱去FeSO4·7H2O的结晶水
c.抑制Fe3+水解 d.作为氧化剂
(3)检验Fe2+已经完全被氧化需使用的试剂是_________。
(4)研究相同时间内温度与NaClO3用量对Fe2+氧化效果的影响,设计对比实验如下表
编号 | T/℃ | FeSO4·7H2O/g | NaClO3/g | 氧化效果/% |
i | 70 | 25 | 1.6 | a |
ii | 70 | 25 | m | b |
iii | 80 | n | 2.0 | c |
iv | 80 | 25 | 1.6 | 87.8 |
①m=______;n=______。
②若c>87.8>a,则a、b、c的大小关系为___________。
(5)加入NaOH溶液制备Fe(OH)3的过程中,若降低水浴温度,Fe(OH)3的产率下降,其原因是___
(6)判断Fe(OH)3沉淀洗涤干净的实验操作为_________________;
(7)设计实验证明制得的产品含FeOOH(假设不含其他杂质)。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJmol-1表示。请认真观察图1,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应。

(2)已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将________转化为________。
(3)某实验小组同学进行如图2的实验,以探究化学反应中的能量变化。实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是________(填“吸热”或“放热”)反应;实验②中,该小组同学在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,该反应是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体X只可能由A1、(NH4)2SO4 ,MgCl2.FeCl2, AlCl3中的一种或几种组成,某同学对该固体进行了如下实验

下列判断正确的是
A.气体甲一定是纯净物B.固体X中一定不存在FeCl2
C.白色沉淀甲可能是混合物D.固体X中一定存在AlCl3、(NH4)2SO4, MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,0.2mol NH3与_________________g H2O的电子数相等。
(2)含有相同氧原子数的CO和CO2,其质量比为_________________________。
(3)已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的摩尔质量__________。
(4)已知V mLAl2(SO4)3溶液中含Al3+ a g,则溶液中SO42-的物质的量浓度是_____________。
(5)下列8种化学符号:11H2、12H2、614C、36Li、1123Na、714N、37Li、1224Mg。
①表示核素的符号共________种。
②互为同位素的是________。
③中子数相等,但质子数不相等的核素是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体![]() 常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为____。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因_____
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
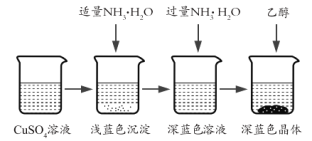
(3)已知浅蓝色沉淀的成分为![]() ,试写出生成此沉淀的离子反应方程式_________。
,试写出生成此沉淀的离子反应方程式_________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是__。
III.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL C1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
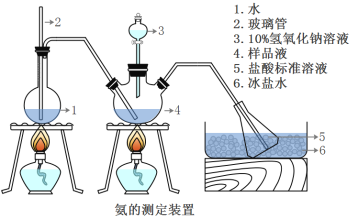
(5)A装置中长玻璃管的作用_____,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏低的原因是_______。
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图。

(1)步骤①中除去粗盐中杂质(Mg2+、SO![]() 、Ca2+),加入的药品顺序正确的是__________。
、Ca2+),加入的药品顺序正确的是__________。
A. NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C. NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D. BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
(2)步骤⑤中已获得Br2,步骤⑥中又用SO2的水溶液将Br2吸收,其目的是___________。
(3)写出步骤⑥中发生反应的离子方程式:_______________。
(4)把溴吹入到SO2的水溶液的气体X最可能用下面的___(填序号)。
A. 乙烯 B. 空气 C. 氩气 D. CO2
(5)由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由弱到强的顺序是___________。
(6)钛是航空、军工、电力等方面的必需原料。常温下钛不与非金属、强酸反应,红热时,却可与常见的非金属单质反应。目前大规模生产钛的方法是:TiO2、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体。该反应的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com