
【题目】Fe(OH)3广泛应用于医药制剂、颜料制造等领域,其制备步骤及装置如下:在三颈烧瓶中加入16.7gFeSO4·7H2O和40.0ml蒸馏水。边搅拌边缓慢加入3.0mL浓H2SO4,再加入2.0gNaClO3固体。水浴加热至80℃,搅拌一段时间后,加入NaOH溶液,充分反应。经过滤、洗涤、干燥得产品。
(1)NaClO3氧化FeSO4·7H2O的离子方程式为_____________。
(2)加入浓硫酸的作用为_________(填标号)。
a.提供酸性环境,增强NaClO3氧化性 b.脱去FeSO4·7H2O的结晶水
c.抑制Fe3+水解 d.作为氧化剂
(3)检验Fe2+已经完全被氧化需使用的试剂是_________。
(4)研究相同时间内温度与NaClO3用量对Fe2+氧化效果的影响,设计对比实验如下表
编号 | T/℃ | FeSO4·7H2O/g | NaClO3/g | 氧化效果/% |
i | 70 | 25 | 1.6 | a |
ii | 70 | 25 | m | b |
iii | 80 | n | 2.0 | c |
iv | 80 | 25 | 1.6 | 87.8 |
①m=______;n=______。
②若c>87.8>a,则a、b、c的大小关系为___________。
(5)加入NaOH溶液制备Fe(OH)3的过程中,若降低水浴温度,Fe(OH)3的产率下降,其原因是___
(6)判断Fe(OH)3沉淀洗涤干净的实验操作为_________________;
(7)设计实验证明制得的产品含FeOOH(假设不含其他杂质)。___________。
【答案】ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O a、c K3[Fe(CN)6]溶液 2.0 25 c>b>a 若温度过低,Fe(OH)3胶体未充分聚沉收集,导致产率下降 取最后一次洗涤液于两只试管中,分别滴加HCl酸化的BaCl2溶液和HNO3酸化的AgNO3溶液,若都无白色沉淀,则说明Fe(OH)3沉淀洗涤干净 称取mg样品,加热至恒重后称重,剩余固体质量大于![]()
【解析】
(1)NaClO3具有氧化性,在酸性条件下将FeSO4·7H2O氧化为硫酸铁,据此书写;
(2) NaClO3具有氧化性,在酸性条件下氧化性增强;同时反应产生的Fe3+会发生水解反应,根据盐的水解规律分析分析;
(3)检验Fe2+已经完全被氧化,就要证明溶液在无Fe2+;
(4)实验是研究相同时间内温度与NaClO3用量对Fe2+氧化效果的影响,根据表格数据可知i、ii是研究NaClO3用量的影响;ii、iii或i、iv是研究温度的影响;据此分析解答;
(5)温度低,盐水解程度小,不能充分聚沉;
(6) Fe(OH)3沉淀是从含有NaCl、H2SO4的溶液在析出的,只要检验无Cl-或SO42-就可证明洗涤干净;
(7)根据Fe元素守恒,若含有FeOOH,最后得到的固体质量比Fe(OH)3多。
(1)NaClO3具有氧化性,在酸性条件下将FeSO4·7H2O氧化为硫酸铁,NaClO3被还原为NaCl,同时产生水,反应的离子方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(2) NaClO3氧化FeSO4·7H2O时,为了增强其氧化性,要加入酸,因此提供酸性环境,增强NaClO3氧化性,选项a合理;同时FeSO4·7H2O被氧化为Fe2(SO4)3,该盐是强酸弱碱盐,在溶液中Fe3+发生水解反应使溶液显酸性,为抑制Fe3+的水解,同时又不引入杂质离子,因此要向溶液中加入硫酸,选项c合理,故答案为ac;
(3)检验Fe2+已经完全被氧化,只要证明溶液中无Fe2+即可,检验方法是取反应后的溶液少许,向其中滴加K3[Fe(CN)6]溶液,若溶液无蓝色沉淀产生,就证明Fe2+已经完全被氧化为Fe3+;
(4)①根据实验目的,i、ii是在相同温度下,研究NaClO3用量的影响,ii、iii或i、iv是研究温度的影响;因此m=2,n=25;
②在其它条件不变时,增大反应物的浓度,化学反应速率加快,实验b>a;ii、iii的反应物浓度相同时,升高温度,化学反应速率大大加快,实验c>b,因此三者关系为c>b>a;
(5)加入NaOH溶液制备Fe(OH)3的过程中,若降低水浴温度,Fe(OH)3的产率下降,原因是温度过低,Fe(OH)3胶体未充分聚沉收集,导致产率下降;
(6) Fe(OH)3沉淀是从含有NaCl、H2SO4的溶液在析出的,若最后的洗涤液中无Cl-或SO42-就可证明洗涤干净。方法是取最后一次洗涤液于两只试管中,分别滴加HCl酸化的BaCl2溶液和HNO3酸化的AgNO3溶液,若都无白色沉淀,则说明Fe(OH)3沉淀洗涤干净;
(7)在最后得到的沉淀Fe(OH)3中若含有FeOOH,由于Fe(OH)3中比FeOOH中Fe元素的含量多。由于1molFe(OH)3质量是107g,完全灼烧后产生0.5molFe2O3,质量是80g,若称取mg Fe(OH)3,完全灼烧后固体质量是![]() ,若样品中含有FeOOH,加热至恒重后称重,剩余固体质量大于
,若样品中含有FeOOH,加热至恒重后称重,剩余固体质量大于![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是

A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A. 11g超重水(T2O)含中子数为5NA
B. 25℃,pH=13的1L Ba(OH)2溶液中OH—的数目为0.2NA
C. 1mol金刚石中C—C键的数目为2NA
D. 常温下,pH=6的MgCl2溶液中H+的数目为10-6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
![]()
若A 是一种淡黄色固体单质.则C与H2O反应的生成物为______(填化学式)。
(2)Na2O2也是一种淡黄色固体,Na2O2与CO2反应生成O2和_______(填化学式)。
(3)写出在催化剂作用下N2与H2合成氨的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期元素。n、p、r是由这些元素组成的二元化合物。m 是元素W的单质。q是元素Y的单质且是制作太阳能电池的原料。p在常温下为常见无色液体,0.010mol·L-1的r溶液中c(H+)为0.010 mol·L-1,s是弱酸且不溶于水。上述物质的转化关系如图所示。下列说法不正确的是

A.r易溶于p
B.原子半径:Z<Y
C.最高价氧化物对应水化物的酸性:Y<Z
D.最简单氢化物的稳定性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在2L的密闭容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为______。
②若X、Y、Z均为气体,2min时反应达到平衡,此时体系内压强与开始时的压强之比为____。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时__(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数的说法中不正确的是( )
A.6.02×1023叫做阿伏加德罗常数
B.12g12C含有的碳原子数就是阿伏加德罗常数的值
C.含有阿伏加德罗常数值个微粒的物质是1mol
D.1.5molH2O含有9.03×1023个水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:
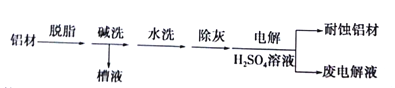
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列中的______。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(2)以铝材为阳极,在![]() 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______
溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______
取少量废电解液,加入![]() 溶液后产生气泡和白色沉淀,产生沉淀的原因是______(用化学用语回答)
溶液后产生气泡和白色沉淀,产生沉淀的原因是______(用化学用语回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如图所示:

(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com