
°æƒø°ø‘⁄ªØ—ß∑¥”¶÷–£¨÷ª”–º´…Ÿ ˝ƒÐ¡ø±»∆Ωæ˘ƒÐ¡ø∏þµ√∂ýµƒ∑¥”¶ŒÔ∑÷◊”∑¢…˙≈ˆ◊≤ ±≤≈ø…ƒÐ∑¢…˙ªØ—ß∑¥”¶£¨’‚–©∑÷◊”±ª≥∆Œ™ªÓªØ∑÷◊”°£ π∆’Õ®∑÷◊”±‰≥…ªÓªØ∑÷◊”À˘–ËÃ·π©µƒ◊ÓµÕœÞ∂»µƒƒÐ¡øΩ–ªÓªØƒÐ£¨∆‰µ•ŒªÕ®≥£”√kJmol£≠1±Ì æ°£«Î»œ’Êπ€≤ÏÕº1£¨»ª∫Ûªÿ¥Œ °£
£®1£©Õº÷–À˘ æ∑¥”¶ «________£®ÃÓ°∞Œ¸»»°±ªÚ°∞∑≈»»°±£©∑¥”¶°£

£®2£©“—÷™≤ø™1mol H©ÅHº¸°¢1mol I©ÅI°¢1mol H©ÅIº¸∑÷±–Ë“™Œ¸ ’µƒƒÐ¡øŒ™436kJ°¢151kJ°¢299kJ°£‘Ú”…1mol«‚∆¯∫Õ1mol µ‚∑¥”¶…˙≥…HIª·________£®ÃÓ°∞∑≈≥ˆ°±ªÚ°∞Œ¸ ’°±£©________kJµƒ»»¡ø°£‘⁄ªØ—ß∑¥”¶π˝≥Ã÷–£¨ «Ω´________◊™ªØŒ™________°£
£®3£©ƒ≥ µ—È–°◊ÈÕ¨—ßΩ¯––»ÁÕº2µƒ µ—È£¨“‘ÃΩæøªØ—ß∑¥”¶÷–µƒƒÐ¡ø±‰ªØ°£ µ—ȱÌ√˜£∫¢Ÿ÷–µƒŒ¬∂»ΩµµÕ£¨”…¥À≈–∂œ«‚—ıªØ±µæßÃ”ά»ªØÔßæßÃÂ∑¥”¶ «________£®ÃÓ°∞Œ¸»»°±ªÚ°∞∑≈»»°±£©∑¥”¶£ª µ—È¢⁄÷–£¨∏√–°◊ÈÕ¨—ß‘⁄…’±≠÷–º”»Î5mL 1.0mol/L—ŒÀ·£¨‘Ÿ∑≈»Î”√…∞÷Ω¥Úƒ•π˝µƒ¬¡Ãı£¨∏√∑¥”¶ «________£®ÃÓ°∞Œ¸»»°±ªÚ°∞∑≈»»°±£©∑¥”¶°£
°æ¥∞∏°ø∑≈»» ∑≈≥ˆ 11 ªØ—߃Р»»ƒÐ Œ¸»» ∑≈»»
°æΩ‚Œˆ°ø
(1)“¿æðÕºœÛ∑÷Œˆ∑¥”¶ŒÔµƒƒÐ¡ø¥Û”⁄…˙≥…ŒÔµƒƒÐ¡ø£¨∑¥”¶∑≈»»£ª
(2)‘⁄∑¥”¶H2+I22HI÷–£¨∂œ¡—1molH-Hº¸£¨1molI-Iº¸π≤Œ¸ ’µƒƒÐ¡øŒ™£∫1°¡436kJ+151kJ=587kJ£¨…˙≥…2molHI£¨π≤–Œ≥…2molH-Iº¸£¨∑≈≥ˆµƒƒÐ¡øŒ™£∫2°¡299kJ=598kJ£¨Œ¸ ’µƒƒÐ¡ø…Ÿ£¨∑≈≥ˆµƒƒÐ¡ø∂ý£¨À˘“‘∏√∑¥”¶Œ™∑≈»»∑¥”¶£¨∑≈≥ˆµƒ»»¡øŒ™£∫598kJ-587kJ=11kJ£¨‘⁄ªØ—ß∑¥”¶π˝≥Ã÷–£¨Ω´ªØ—߃Ð◊™ªØŒ™»»ƒÐ£ª
(3)¢Ÿ÷–µƒŒ¬∂»ΩµµÕÀµ√˜∏√∑¥”¶ «Œ¸»»∑¥”¶£ªªÓ∆√Ω Ù÷√ªªÀ·÷–«‚µƒ∑¥”¶Œ™∑≈»»∑¥”¶°£



| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øNA «∞¢∑¸º”µ¬¬Þ≥£ ˝µƒ÷µ£¨œ¬¡–Àµ∑®’˝»∑µƒ «£® £©
A. 11g≥¨÷ÿÀÆ(T2O)∫¨÷–◊” ˝Œ™5NA
B. 25°Ê£¨pH=13µƒ1L Ba(OH)2»Ð“∫÷–OH°™µƒ ˝ƒøŒ™0.2NA
C. 1molΩ∏’ Ø÷–C°™Cº¸µƒ ˝ƒøŒ™2NA
D. ≥£Œ¬œ¬£¨pH=6µƒMgCl2»Ð“∫÷–H+µƒ ˝ƒøŒ™10-6NA
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–πÿ”⁄∞¢∑¸º”µ¬¬Þ≥£ ˝µƒÀµ∑®÷–≤ª’˝»∑µƒ «£® £©
A.6.02°¡1023Ω–◊ˆ∞¢∑¸º”µ¬¬Þ≥£ ˝
B.12g12C∫¨”–µƒÃº‘≠◊” ˝æÕ «∞¢∑¸º”µ¬¬Þ≥£ ˝µƒ÷µ
C.∫¨”–∞¢∑¸º”µ¬¬Þ≥£ ˝÷µ∏ˆŒ¢¡£µƒŒÔ÷ «1mol
D.1.5molH2O∫¨”–9.03°¡1023∏ˆÀÆ∑÷◊”
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∂‘Ω Ù÷∆∆∑Ω¯––øπ∏Ø ¥¥¶¿Ì£¨ø…—”≥§∆‰ π”√ Ÿ√¸°£“‘œ¬Œ™¬¡≤ƒ±Ì√Ê¥¶¿Ìµƒ“ª÷÷∑Ω∑®£∫
£®1£©ºÓœ¥µƒƒøµƒ «≥˝»•¬¡≤ƒ±Ì√ʵƒ◊‘»ª—ıªØƒ§£¨ºÓœ¥ ±≥£”–∆¯≈ð√∞≥ˆ£¨‘≠“Ú «______£®”√¿Î◊”∑Ω≥Ã Ω±Ì æ£©°£Œ™Ω´ºÓœ¥≤€“∫÷–µƒ¬¡“‘≥¡µÌ–Œ Ωªÿ ’£¨◊Ó∫√œÚ≤€“∫÷–º”»Îœ¬¡–÷–µƒ______°£
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
£®2£©“‘¬¡≤ƒŒ™—Ùº´£¨‘⁄![]() »Ð“∫÷–µÁΩ‚£¨¬¡≤ƒ±Ì√Ê–Œ≥…—ıªØƒ§£¨—Ùº´µÁº´∑¥”¶ ΩŒ™______
»Ð“∫÷–µÁΩ‚£¨¬¡≤ƒ±Ì√Ê–Œ≥…—ıªØƒ§£¨—Ùº´µÁº´∑¥”¶ ΩŒ™______
»°…Ÿ¡ø∑œµÁΩ‚“∫£¨º”»Î![]() »Ð“∫∫Û≤˙…˙∆¯≈ð∫Õ∞◊…´≥¡µÌ£¨≤˙…˙≥¡µÌµƒ‘≠“Ú «______£®”√ªØ—ß”√”Ôªÿ¥£©
»Ð“∫∫Û≤˙…˙∆¯≈ð∫Õ∞◊…´≥¡µÌ£¨≤˙…˙≥¡µÌµƒ‘≠“Ú «______£®”√ªØ—ß”√”Ôªÿ¥£©
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øŒ™ÃΩæø¬¡∆¨£®Œ¥¥Úƒ•£©”ÎNa2CO3»Ð“∫µƒ∑¥”¶£¨ µ—È»Áœ¬£∫
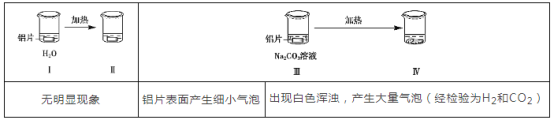
œ¬¡–Àµ∑®≤ª’˝»∑µƒ «£® £©
A. Na2CO3»Ð“∫÷–¥Ê‘⁄ÀÆΩ‚∆Ω∫‚£∫CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. ∂‘±»¢Ò°¢¢Û£¨Õ∆≤‚Na2CO3»Ð“∫ƒÐ∆∆ªµ¬¡±Ì√ʵƒ—ıªØƒ§
C. ¢Ù»Ð“∫÷–ø…ƒÐ¥Ê‘⁄¥Û¡øAl3+
D. Õ∆≤‚≥ˆœ÷∞◊…´ªÎ◊«µƒø…ƒÐ‘≠“Ú£∫AlO2-+HCO3-+H2O=Al(OH)3°˝+CO32-
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–∏˜∑¥”¶¥ÔµΩªØ—ß∆Ω∫‚£¨º”—πªÚΩµŒ¬∂ºƒÐ πªØ—ß∆Ω∫‚œÚƒÊ∑¥”¶∑ΩœÚ“∆∂صƒ «
A. 2NO2![]() N2O4£®’˝∑¥”¶Œ™∑≈»»∑¥”¶£© B. C£®s£©+CO2
N2O4£®’˝∑¥”¶Œ™∑≈»»∑¥”¶£© B. C£®s£©+CO2![]() 2CO£®’˝∑¥”¶Œ™Œ¸»»∑¥”¶£©
2CO£®’˝∑¥”¶Œ™Œ¸»»∑¥”¶£©
C. N2+3H2![]() 2NH3£®’˝∑¥”¶Œ™∑≈»»∑¥”¶£© D. H2S
2NH3£®’˝∑¥”¶Œ™∑≈»»∑¥”¶£© D. H2S![]() H2+S£®s£©£®’˝∑¥”¶Œ™Œ¸»»∑¥”¶£©
H2+S£®s£©£®’˝∑¥”¶Œ™Œ¸»»∑¥”¶£©
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
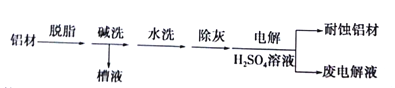
°æƒø°ø£®10∑÷£©¬¡‘™Àÿ‘⁄◊‘»ªΩÁ÷–÷˜“™¥Ê‘⁄”⁄¬¡Õ¡øÛ£®÷˜“™≥…∑÷Œ™Al2O3£¨ªπ∫¨”–Fe2O3°¢FeO°¢SiO2£©÷–°£π§“µ…œ”√¬¡Õ¡øÛ÷∆±∏¬¡µƒƒ≥÷÷ªØ∫œŒÔµƒπ§“’¡˜≥ûÁœ¬°£

£®1£©‘⁄¬À“∫A÷–º”»Î∆Ø∞◊“∫£¨ƒøµƒ «—ıªØ≥˝Ã˙£¨À˘µ√¬À“∫Bœ‘À·–‘°£
¢ŸºÏ—ȬÀ“∫B÷– «∑Òªπ∫¨”–Ã˙‘™Àÿµƒ∑Ω∑®Œ™£∫ £®◊¢√˜ ‘º¡°¢œ÷œÛ£©°£
¢⁄Ω´¬À“∫B÷–µƒ¬¡‘™Àÿ“‘≥¡µÌ–Œ ΩŒˆ≥ˆ£¨ø…—°”√µƒ◊Ó∫√ ‘º¡Œ™ £®ÃÓ¥˙∫≈£©°£
a£Æ«‚—ıªØƒ∆»Ð“∫ b£Æ¡ÚÀ·»Ð“∫ c£Æ∞±ÀÆ d£Æ∂˛—ıªØú
¢€”…¬À“∫B÷∆±∏¬»ªØ¬¡æßÃ…ʺ∞µƒ≤Ÿ◊˜Œ™£∫±þµŒº”≈®—ŒÀ·±þ’Ù∑¢≈®Àı°¢¿‰»¥Ω·æß°¢
£®ÃÓ≤Ÿ◊˜√˚≥∆£©°¢œ¥µ”°£
¢Ð∏√π˝≥Ã÷–…ʺ∞ƒ≥—ıªØªπ‘≠∑¥”¶»Áœ¬£¨«ÎÕÍ≥…≈‰∆Ω£∫
Fe2++ ClO£≠+ = Fe(OH)3°˝+ C1£≠+
£®2£©SiO2∫ÕNaOH±∫…’÷∆±∏πËÀ·ƒ∆£¨ø…≤…”√µƒ◊∞÷√Œ™ £®ÃÓ¥˙∫≈£©°£

≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¿˚”√∑œæ…∂∆–øÃ˙∆§ø…÷∆±∏¥≈–‘Fe3O4Ω∫á£◊”º∞∏±≤˙ŒÔZnO,÷∆±∏¡˜≥ûÁÕºÀ˘ æ£∫

(1)¥”¡˜≥ÃÕºø…÷™,Zn°¢Fe÷–ƒÐ”ÎNaOH»Ð“∫∑¥”¶µƒ «________°£
(2)Zn(OH)2≥¡µÌº”»»ø…µ√ZnO,∏√∑¥”¶______£®ÃÓ°∞ «°±ªÚ°∞≤ª «°±£©—ıªØªπ‘≠∑¥”¶°£
(3)œÚ≤ª»ÐŒÔ÷–º”»Îœ°H2SO4∑¢…˙∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ω «_________°£
(4)º”»Î ¡øH2O2µƒƒøµƒ «_________°£
(5)»Á∫Œ÷§√˜“—…˙≥…¡ÀFe3O4Ω∫ÃÂ? _________°£
(6)¡˜≥Ã÷–À˘–˵ƒ¡ÚÀ·»Ð“∫”…Ωπ¡ÚÀ·(H2SO4°§SO3)»Ð”⁄ÀÆ≈‰÷∆∂¯≥…£¨∆‰÷–µƒSO3∂º◊™ªØŒ™¡ÚÀ·£¨»ÙΩ´445gΩπ¡ÚÀ·»Ð”⁄ÀÆ≈‰≥…4.00L ¡ÚÀ·£¨∏√¡ÚÀ·µƒŒÔ÷ µƒ¡ø≈®∂»Œ™______mol/L°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø±Í∫≈Œ™¢Ÿ°´¢‚µƒ‘™Àÿ£¨‘⁄‘™Àÿ÷Ð∆⁄±Ì÷–µƒŒª÷√»Áœ¬£∫
÷˜◊ ÷Ð∆⁄ | ¢ÒA | ¢ÚA | ¢ÛA | ¢ÙA | ¢ıA | ¢ˆA | ¢˜A | 0◊ |
1 | ¢Ÿ | ¢⁄ | ||||||
2 | ¢€ | ¢Ð | ¢ð | ¢Þ | ||||
3 | ¢þ | ¢ý | ¢· | ¢‚ |
‘ªÿ¥œ¬¡–Œ £∫
£®1£©–¥≥ˆ‘™Àÿ¢€µƒ√˚≥∆__°£
£®2£©¢Ÿ∫Õ¢Ð∫≈‘™Àÿ–Œ≥…µƒªØ∫œŒÔµƒªØ—ß ΩŒ™__£¨”√µÁ◊” Ω±Ì æ∆‰–Œ≥…π˝≥ÃŒ™__°£
£®3£©¢þ∫Õ¢ý∫≈‘™Àÿµƒ◊Ó∏þº€—ıªØŒÔµƒÀƪ،ԵƒºÓ–‘ «£∫__©É__
£®4£©¢Ÿ°¢¢ð°¢¢þ∫≈‘™Àÿ–Œ≥…µƒ“ª÷÷ªØ∫œŒÔµƒµÁ◊” Ω «__£¨‘⁄∏√ªØ∫œŒÔ÷–º»∫¨”–__º¸£¨”÷∫¨”–__º¸°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com