
【题目】气体A的产量可以用来衡量一个国家石油化工发展水平。下图是由A为原料生产B的转化关系图,B是一种有香味的液体。

(1)将A通入溴水中,观察到的实验现象是__________,A分子中的官能团是______。
(2)写出CH3CH2OH与CH3COOH反应生成B的化学方程式_____________________。
(3)写出乙醇的一种用途____________________________________。
【答案】溴水褪色(或溶液褪色,合理答案均可得分) 碳碳双键(或![]() ) CH3COOH+CH3CH2OH
) CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 燃料(或化工原料等,合理答案均可得分)
CH3COOCH2CH3+H2O 燃料(或化工原料等,合理答案均可得分)
【解析】
气体A的产量可以用来衡量一个国家石油化工发展水平,则A为CH2=CH2,乙酸和乙醇在浓硫酸催化作用和加热的条件下发生酯化反应生成乙酸乙酯,则B为CH3COOCH2CH3。
(1)A为CH2=CH2,官能团为碳碳双键(或![]() ),能与溴发生加成反应而使溴水褪色,故答案为:溴水褪色(或溶液褪色,合理答案均可得分);碳碳双键(或
),能与溴发生加成反应而使溴水褪色,故答案为:溴水褪色(或溶液褪色,合理答案均可得分);碳碳双键(或![]() );
);
(2)CH3CH2OH与CH3COOH在浓硫酸催化作用和加热的条件下反应生成乙酸乙酯和水,方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(3)乙醇的用途很多,比如作燃料,化工原料等,故答案为:燃料(或化工原料等,合理答案均可得分)。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2X(g)+Y(g)![]() 2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
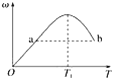
A. T1时,v正>v逆
B. 正反应的ΔH<0
C. a、b两点的反应速率v(a)=v(b)
D. 当温度低于T1时,ω增大的原因是平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生实验小组用50mL 1.0mol·L-1的盐酸与50mL 1.1mol·L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定。
(1)图中装置缺少的一种仪器,该仪器名称为_________。
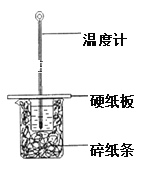
(2)如果改用60mL 1.Omol·L-1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量____________(填“增加” “减少”或“不变”),所求中和热数值 ________ (填“增加”“减少”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
主族 周期 | ⅠA | 0族 | ||||||
一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
二 | ② | |||||||
三 | ③ | ④ | ⑤ | ⑥ | ||||
(1)最活泼的金属元素是_______________(填元素符号)
(2)②和⑤两种元素原子半径较大的是_______________(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的是_____________(填元素符号);
(3)写出①的单质在⑥的单质中燃烧的化学方程式_______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位为铜、铝、铅、锌、镍。
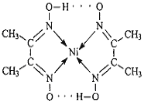
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___晶体;基态Ni原子的价电子电子排布式为____。
(2)铜原子的电子占有____种能量不同的原子轨道。
(3)配合物分子内(如图)的作用力有_____(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
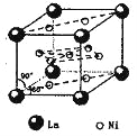
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______。
(6)邻羟基苯甲醛的沸点____(填大于,小于或等于)对羟基苯甲醛的沸点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z均为元素周期表中前20号元素,X和Z位于同一周期,Y的阳离子和Z的阴离子的核外电子排布相同,Y2Z2与H2Z或XZ2反应都能生成单质气体Z2。
(1)写出元素名称:X________,Y________,Z________。
(2)写出下列物质的电子式:Y2Z2__________________,XZ2__________________。
(3)用电子式表示Y2Z的形成过程:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙醇的化学性质中,各反应的断键方式可概括如图:
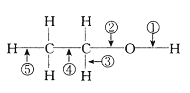
用序号填空:
(1)消去反应的断键位置是___________,化学方程式为________________。
(2)与金属Na反应的断键位置是___________,化学方程为________________。
(3)催化氧化的断键位置是________________,化学方程为_______________。
(4)分子间脱水的断键位置是___________,化学方程为________________。
(5)与HBr反应的断键位置是_______________,化学方程为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列装置完成系列实验,下列说法正确的是( )

A. 铜和浓硝酸的反应与铜和浓硫酸的反应一样需要加热条件下才能进行
B. BaCl2溶液中会出现白色沉淀BaSO3
C. H2S溶液中会出现黄色沉淀,体现了SO2的还原性
D. 为验证碳、硅非金属性的相对强弱,A试管中的试剂可以是KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com