


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、浓硝酸可保存在带橡皮塞的棕色细口瓶中 |
| B、用pH试纸测定溶液pH时,pH试纸应事先润湿 |
| C、配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定 |
| D、中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
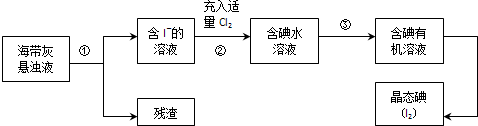
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 15 |
| 16 |
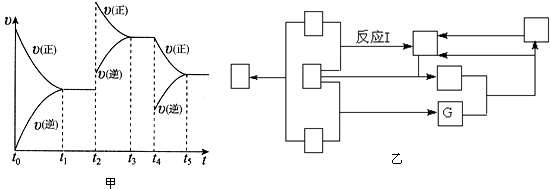
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com