
【题目】设NA表示阿伏加德罗常数,下列叙述不正确的是
A.常温常压下,NA个CO2分子的质量总和为44 g
B.常温常压下,1mol氦气含有的核外电子数为4 NA
C.12.4 g 白磷(P4)中含有的磷原子数为0.4 NA
D.0.1 mol·L-1稀硫酸100 mL中含硫酸根个数为0.1 NA
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)下列每组分别给出了两个量,其中可以组成一个物质的量公式的组有(填编号)___________
① | ② | ③ | ④ | ⑤ |
物质所含的微粒数 | 固体体积 | 溶液的质量百分比浓度 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
(2)在标准状况下:①6.72LCH4, ②3.01×1023个HCl分子, ③13.6gH2S, ④0.2molNH3,下列对这四种气体的描述正确的是(填写代号)___________
A.质量②>③>①>④ B.密度②>③>④>① C.体积②>③>①>④ D.氢原子数①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
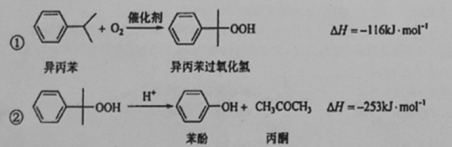
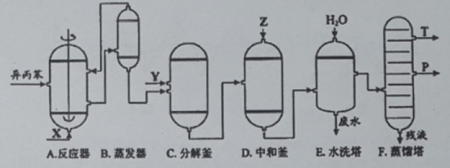
相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)。
a. NaOH b. CaCO3 c. NaHCO3 d. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞物质组成的叙述,正确的是
A. 在人体活细胞中氢原子的数目最多
B. DNA和RNA分子的碱基组成相同
C. 多糖在细胞中只能作为储能物质
D. 蛋白质区别于脂质的特有元素是氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方式书写正确的是( )
A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
B.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O = Fe(OH)3↓+3H+
C.Na2S溶液中滴加NaClO溶液:S2-+ClO–+H2O=S↓+Cl-+2OH-
D.将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A,标准状况下的密度为1.25g/L。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,E有香味。它们之间的转化关系如下图所示:


(1)A的电子式为 ,D中官能团的名称为 。
(2)以A为原料自身合成高分子化合物的化学方程式为 ,反应类型是 。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如右图所示)。观察到的现象是 ,重复操作2-3次。写出过程②反应方程式 。
(4)B、D在浓硫酸的作用下实现反应③,实验装置如下图所示:

①试管1中实现反应③的化学方程式为 ,
②反应开始时用酒精灯对试管小火加热的原因是: 。(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:N2 + 3H2 ![]() 2NH3。
2NH3。
某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内的平均反应速率 v(N2) = 。
(2)250s时,H2的转化率为 。
(3)已知![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化 kJ。下图能正确表示该反应中能量变化的是________。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化 kJ。下图能正确表示该反应中能量变化的是________。

(4)为加快反应速率,可以采取的措施
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
(5)下列说法错误的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.上述条件下,N2不可能100%转化为NH3
C.为了提高N2的转化率,应适当提高H2的浓度
D.250~350s生成物浓度保持不变,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A.元素C的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒的半径:r(Mg2+) > r(Mg)
C.在该反应条件下,Mg的还原性强于C的还原性
D.该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Al2(SO4)3溶液V mL中含a g Al3+,取出V/4 mL溶液稀释成4V mL后,SO42-的物质的量浓度为( )
A.125/54V mol·L-1 B.125a/36V mol·L-1
C.125a/18V mol·L-1 D.125a/V mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com