
| △c |
| △t |
| 0.8mol/L |
| 4s |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B、能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C、取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D、H++OH-═H2O可描述所有酸碱中和反应的实质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
I A | II A | III A | IV A | VA | VI A | VII A |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
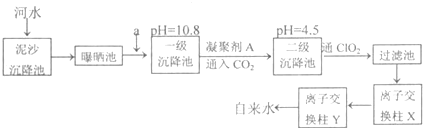
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
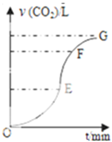 用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).
用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com