
【题目】对下列化学物质进行分类,正确的是
A.海水、冰水混合物、氨水均为混合物
B.SO3、CO2、CaO均为酸性氧化物
C.烧碱、纯碱、硫酸钡均为电解质
D.氢硫酸、盐酸、硝酸均为强酸
科目:高中化学 来源: 题型:
【题目】某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题: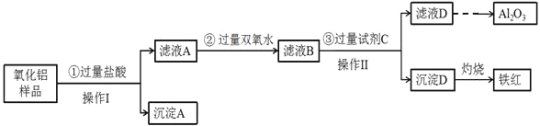
(1)操作I的名称是_________;写出沉淀A和烧碱溶液反应的化学方程式__________。
(2)滤液A中加入过量双氧水的目的是___________;验证滤液A中存在Fe3+的具体操作和现象为:_________________。
(3)滤液D焰色反应呈黄色,试剂C是_________(填化学式);步骤③中铝元素转化的离子方程式为 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:
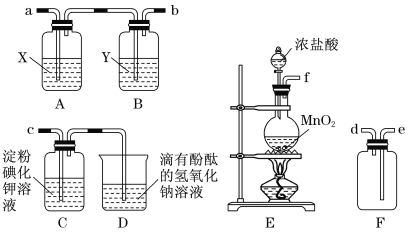
请回答下列问题:
(1)整套实验装置的连接顺序是f接( ) ( )接( )( )接( )(各接口处的字母代号)。_________
(2)E装置中制取氯气的离子方程式是_________________________。
(3)B装置的作用是__________________;A装置中试剂X是________________。
(4)C装置中可观察到的现象是____________。
(5)ClO2和氯气具有相似的性质,用如图装置可以测定某混合气中ClO2 的含量:(其他成分不参与反应)
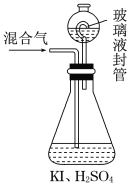
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0 mol·L-1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂
显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
A. 锥形瓶内ClO2与碘化钾反应的离子方程式为__________________________________。
B. 测得混合气中ClO2的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X可作为合成青蒿素的一种基本原料,已知X的结构如下,下列有关X的说法正确的是
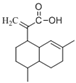 ( )
( )
A. X为烃的含氧衍生物
B. X最多可以和3mol H2发生加成反应
C. X只能发生取代反应和加成反应
D. X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂试剂的选择或除杂操作正确的是( )
选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
A | CO2(SO2) | 饱和Na2CO3溶液 | 将气体通过足量的Na2CO3溶液 |
B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
C | NO2(NO) | H2O | 将气体通入水中 |
D | NH3(H2O) | 浓硫酸 | 气体通入浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是

A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类正确的是( )
A. 氯水、水玻璃、明矾都是混合物
B. CO2、NO2、P2O5均为酸性氧化物
C. 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
D. 根据分散系粒子直径的大小将分散系分为溶液、胶体和浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com