
【题目】下列解释物质用途或现象的反应方程式不准确的是( )
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 ![]() 2H2SO4
2H2SO4
B.工业上制取粗硅的化学方程式:SiO2+C ![]() Si+CO2↑
Si+CO2↑
C.Na2 S203溶液中加入稀硫酸:S2O+2H ![]() ═SO2+S↓+HO2
═SO2+S↓+HO2
D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl﹣+ClO﹣+2H+═Cl2↑+H20
【答案】B
【解析】解:A.正常雨水溶解二氧化碳,酸雨中溶解二氧化硫,酸性增强,二氧化硫与水反应生成H2SO3 , H2SO3可被氧化生成H2SO4 , 则硫酸型酸雨的形成会涉及反应为:2H2SO3+O2 ![]() 2H2SO4 , 故A正确;
2H2SO4 , 故A正确;
B.工业上制硅的反应方程式为:SiO2+2C ![]() Si+2CO↑,故B错误;
Si+2CO↑,故B错误;
C.Na2S203溶液中加入稀硫酸发生氧化还原反应,生成S、二氧化硫、水,该反应为Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,该离子反应为S2O32﹣+2H+=S↓+SO2↑+H2O,故C正确;
D.盐酸与次氯酸钠反应生成氯气,反应的离子方程式为Cl﹣+ClO﹣+2H+=Cl2↑+H2O,故D正确;
故选B.
A.正常雨水溶解二氧化碳,酸雨中溶解二氧化硫,二氧化硫与水反应生成H2SO3 , H2SO3可被氧化生成H2SO4 , 酸性增强;
B.工业上制取粗硅:二氧化硅和碳高温生成硅和CO;
C.硫代硫酸钠和硫酸反应生成硫酸钠、二氧化硫和S、水;
D.盐酸与次氯酸钠发生氧化还原反应生成氯气.


科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取绿矾(FeSO47H2O),设计了如下流程,下列说法不正确的是( )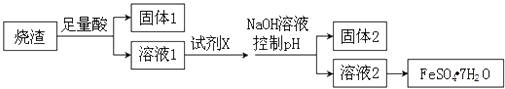
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH是为了使Al3+转化为Al(OH)3 , 进入固体2
C.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
D.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池广泛用作各种电子仪器的电源,它的电池反应是Zn+Ag2OH2O=2Ag+Zn(OH)2则负极上发生反应的物质是( )
A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I是一种新型香料的主要成分之一,其结构中含有三个六元环.I的合成路线如下(部分产物和部分反应条件略去): 
已知:①A中核磁共振氢谱图显示分子中有6种不同化学环境的氢原子.
② ![]()
③C和H是同系物
请回答下列问题:
(1)A→B的化学方程式为 .
D→E 的化学方程式为 .
(2)写出G分子中含有的官能团名称: .
(3)C和H生成I的反应类型为 .
(4)I的结构简式为 .
(5)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的H的同分异构体有种(不包括立体异构),其中核磁共振氢谱为5组峰的为(写结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式为CH3CH=CHCH2COOH,下列有关说法正确的是( )
A. 能与乙醇发生酯化反应
B. 不能使酸性高锰酸钾溶液褪色
C. 能与溴的四氯化碳溶液发生取代反应
D. 1 mol M与足量Na完全反应能生成1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定属于放热反应的是
A. 氢氧化钡晶体和氯化铵晶体的反应
B. 反应物能量比生成物能量低的反应
C. 化学键断裂吸收的能量比化学键形成放出的能量少的反应
D. 不需要加热就能发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。

(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为_____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2,还原为Mn2+,反应的离子方程式为_____________________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2 Na2S2O3=2Na1+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是___________________________;
②用注射器抽取某水样20. 00mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入23滴_______作指示剂;
⑧用0.005 mol L -1 Na2S2O3溶液滴定至终点。滴定终点的现象是___________________________。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________ mg L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将_________ (填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3﹣CH═CH2+HBr﹣→CH3﹣CHBr﹣CH3(主要产物).1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化. 
(1)A的化学式: , A的结构简式: .
(2)上述反应中,①是反应,⑦是反应.(填反应类型)
(3)写出C、D、E、H物质的结构简式: C , D , E , H .
(4)写出D﹣→F反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com