
�����ᣨH3PO3���Ƕ�Ԫ�ᣬH3PO3��Һ���ڵ���ƽ�⣺H3PO3  H+ + H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
H+ + H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
��1����д��������������NaOH��Һ��Ӧ�����ӷ���ʽ____________________________��
��ij�¶��£�0.1000 mol��L��1��H3PO3��ҺpH�Ķ���Ϊ1.6������ʱ��Һ��c (H+) �� 2.5��10��2 mol��L��1����OH��֮���������ӵ�Ũ����С�����˳���� �����¶���H3PO3����ƽ���ƽ�ⳣ��K= ����H3PO3�ڶ���������Բ��ƣ����������λ��Ч���֣�
����H3PO3��Һ�еμ�NaOH��Һ�����ԣ�������Һ��
c(Na+)_______ c(H2PO3��)+ 2c(HPO32��)��������� ������ ��=������
��2�����������ǿ��ԭ�ԣ���ʹ��ˮ��ɫ���÷�Ӧ�Ļ�ѧ����ʽ_______________________��
��3�����Na2HPO3��ҺҲ�ɵõ������ᣬװ��ʾ��ͼ���£�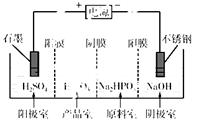
˵������Ĥֻ����������ͨ������Ĥֻ����������ͨ����
�������ĵ缫��ӦʽΪ________________________��
�ڲ�Ʒ���з�Ӧ�����ӷ���ʽΪ________________��
��1�� ��H3PO3+OH����H2PO3��+H2O (2��)
��c(HPO32��)��c(H2PO3��)��c(H+) (2��) 8.3��10��3mol/L(2�֣�д��д��λ����ȷ)
�� �� (2��)
��2��H3PO3+I2+H2O��H3PO4+2HI(2��)
��3����2H++2e����H2�� (2��)
��HPO32��+2H+��H3PO3(2��) ��HPO32��+H+��H2PO3����H2PO3��+H+��H3PO3(��1��)
���������������1�����������Ƕ�Ԫ�ᣬ������������������Ʒ�Ӧ����NaH2PO3��H2O�����Ը÷�Ӧ����ʽΪ��H3PO3+OH-=H2PO3-+H2O���ʴ�Ϊ��H3PO3+OH-=H2PO3-+H2O��
��0.1000mol?L-1��H3PO3��ҺpH�Ķ���Ϊ1.6��������Ũ��С��������Ũ�ȣ������������Ƕ�Ԫ���ᣬ��ˮ�зֲ����룬�ҵ�һ������̶ȴ��ڵڶ��������������ж������������ɣ�����������Ũ���������Ũ�ȴ�С˳����c��HPO32-����c��H2PO3-����c��H+����
H3PO3  H++H2PO3-
H++H2PO3-
��ʼʱ������Ũ�ȣ�mol?L-1�� 0.10 0 0
��Ӧ�ĸ����ʵ�Ũ�ȣ�mol?L-1��2.5��10-2 2.5��10-2 2.5��10-2
ƽ��ʱ�����ʵ�Ũ�ȣ�mol?L-1��0.10-2.5��10-2 2.5��10-22.5��10-2
K��c��H+��c��H2PO3?��/c(c(H3PO3)��2.5��10?2��2.5��10?2/0.10-2.5��10?2=8.3��10-3mol/L��
�ʴ�Ϊ��c��HPO32-����c��H2PO3-����c��H+����8.3��10-3mol/L��
����Һ�����ԣ���C��H+��=C��OH-������Һ�ʵ����ԣ���c��Na+��+C��H+��=C��OH-��+c��H2PO3-��+2c��HPO32-������ΪC��H+��=C��OH-��������c��Na+��=c��H2PO3-��+2c��HPO32-�����ʴ�Ϊ��=��
��2�������ǿ�����ԣ����������ǿ��ԭ�ԣ�����������͵��ܷ���������ԭ��Ӧ�������������ᣬ��Ӧ����ʽΪ��H3PO3+I2+H2O=2HI+H3PO4���ʴ�Ϊ��H3PO3+I2+H2O=2HI+H3PO4��
��3���������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ2H++2e-=H2�����ʴ�Ϊ��2H++2e-=H2����
�ڲ�Ʒ����HPO32-�������ӽ�����������ᣬ��Ӧ���ӷ���ʽΪ��HPO32-+2H+=H3PO3���ʴ�Ϊ��HPO32-+2H+=H3PO3��
���㣺������ʵĵ��롢�缫��Ӧʽ����д���й�ƽ�ⳣ���ļ��㡣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ش��йصζ������е�������⡣
(1)����֪Ũ�ȵ�����������Һ�ζ�δ֪Ũ�ȵ����ᣬ�ζ�������ͼ��ʾ��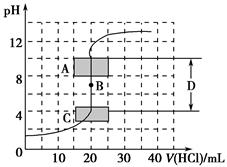
����ͼ��A��pH��Χʹ�õ�ָʾ����________��
C��pH��Χʹ�õ�ָʾ����________��
�����й��������к͵ζ������еIJ�������ȷ����________(�����)��
| A���ü�ʽ�ζ�����ȡ��֪Ũ�ȵ��ռ���Һ |
| B���ζ��ܺ���ƿ�������ô�װҺ��ϴ |
| C���ζ�������ʼ��ע����ƿ����Һ��ɫ�仯 |
| D����ƿ�еĴ���Һ������Ͳ��ȡ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�������ĺ����ϴ�����Ҫ��Ni��������Al��Al2O3��Fe��FeO��Fe2O3�������������ʣ������������ʲ�����Ӧ����ijУ��ѧ�о���ѧϰС�����������ͼ��ʾ�ķ������Ըú����ϴ���Ϊԭ�����Ʊ�NiSO4��7H2O��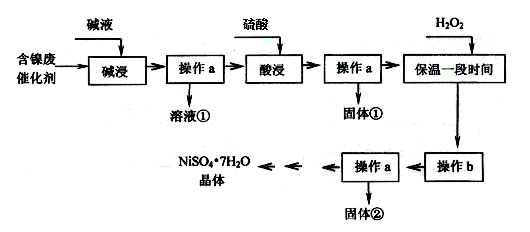
���������ϡ�
��Ni������������ᷴӦ����Ni2+�������Һ��Ӧ��
�ڲ���������������������ʽ����ʱpH���£�
| ������ | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Ni��OH��2 |
| ��ʼ������pH | 4.1 | 1.7 | 7.6 | 7.0 |
| ��ȫ������pH | 5.2 | 3.2 | 9.5 | 9.2 |
 2Ni��OH��2��д���÷�Ӧ�ŵ�ʱ������Ӧʽ ��
2Ni��OH��2��д���÷�Ӧ�ŵ�ʱ������Ӧʽ �� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)25 ��ʱ��0.1 mol��L��1NaOH��Һ��pHΪ________��
(2)25 ��ʱ��0.1 mol��L��1NH4Cl��Һ��pH_____7(�����������������)����ԭ����_________(�����ӷ���ʽ��ʾ)��
(3)������������Һ�������Ϻ�����Ũ�ȴ�С������ȷ����________(�����)��
A��[Na��]��[Cl��]��[OH��]��[H��]
B��[Na��]��[Cl��]��[H��]��[OH��]
C��[Na��]��[Cl��]��[OH��]��[H��]
D��[Cl��]��[Na��]��[OH��]��[H��]
(4) ���������ܵ��������ڵ���ʵ���________(�����)��
A.�� B.���� C.�Ȼ��ƾ��� D.������������
(5) 25��ʱ��0.1 mol��L��1NaOH��Һ��ˮ�����������������Ũ��ΪC1��0.1 mol��L��1NH4Cl��Һ��ˮ��������������ӵ�Ũ��ΪC2����C1 ______C2(�����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£�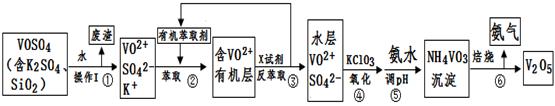
��ش��������⣺
��1����������÷����ijɷ��� ��д��ѧʽ��������I������ ��
��2������ڡ��۵ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+��HA��ʾ�л���ȡ������
R2(SO4)n (ˮ��)+ 2nHA���л��㣩 2RAn���л��㣩 + nH2SO4 (ˮ��)
2RAn���л��㣩 + nH2SO4 (ˮ��)
������ȡʱ��������������ԭ���� ������X�Լ�Ϊ ��
��3���ݵ����ӷ���ʽΪ ��
��4��25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| ��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��pH=13��CH3COONa��Һ��ˮϡ��100����pH�� ��11(�>����=����<��)��ԭ�������������������� ������(�����ӷ���ʽ�ͱ�Ҫ������˵��)��pH��ȵ�NaOH��Һ��CH3COONa��Һ���ֱ���ȵ���ͬ���¶Ⱥ�CH3COONa��Һ��pH����������NaOH��Һ��pH(�>����=����<��)��
��2��pH���ʱ����NH4Cl����(NH4)2SO4����NH4HSO4������Һ��c(NH4+)�ɴ�С��˳��Ϊ���������� ����������
��3�����������Ũ�ȵ���������������Ϻ���Һ���� ���ԣ���Һ��c(Na+)��������c(CH3COO-)(�>����=����<��)��pH=13������������pH=1�Ĵ���������Ϻ���Һ�����������ԣ���Һ��c(Na+)
����������c(CH3COO-)(�>����=����<��)��
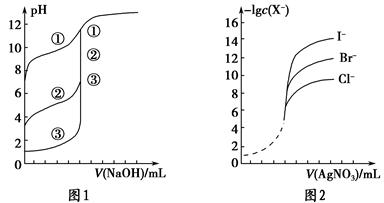
��4��25�棬��0��1000 mol / LNaOH��Һ�ζ�20��00mL0��1000mol/LijһԪ��HA��Һ���õζ�������ͼ��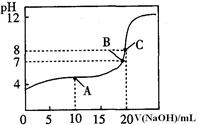
��Ϊ��Сʵ������ͼ��֪�ζ�ʱָʾ��Ӧѡ�� ���ʯ�������̪���������ȡ�����
��A��B��C������ʾ��Һ����������ǿ���� ���Ӧ����Һ��
��25OC��HA�ĵ���ƽ�ⳣ��ԼΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����pH= a��CH3COOH��Һϡ��100����������ҺpH a +2�������������
��0.01mol/LCH3COOH��Һ��pH 2���������������
��0.1mol/LCH3COONa��Һ��pH 7���������������
��2��ij��������Na2CO3��NaOH��MgCl2��AlCl3��BaCl2��Fe2(SO4)3��(NH4)2SO4�е����ֻ�϶��ɡ�ȡ�ù�������ˮ�õ���ɫ������Һ�������Һ�м���ϡ���ᣬ�а�ɫ�������ɣ���������ϡ���ᣬ��������ȫ��ʧ��������������������������� ԭ�����к��������� �� ����д��ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪MOHΪһԪ���25��ʱ�����볣��Kb= 1��10�� 6mol��L��1��
��1��25��ʱ����0.2 mol��L��1 HCl��Һ��0.2 mol��L��1 MOH��Һ��������(���Ի�Ϻ���Һ����ı仯)����û����Һ��pH��6����ʱ�����Һ����ˮ�������c(H��)=Amol��L��1����0.2 mol/L HCl��Һ����ˮ�������c(H��)=Bmol��L��1����
�ٱȽ�A B��(�>������<������)
�ڸ��ݵ���غ㣬��������Һ��c(Cl��)��c(M��)��______ mol��L��1�� (��ȷ���㣬���������)
��2��25��ʱ��0.01 mol��L��1MOH��Һ�� pH=10������������ pH = 4��������Һ��ϣ�������Һ��pH 7���>������<����=�����������ʱ��Һ��M Cl��ˮ��ƽ�ⳣ��Kh= mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij���Ṥ�������Է�ˮ���飨As��Ԫ�غ������ߣ�Ϊ��������ŷţ����û�ѧ���������������ˮ�������������£�
����������±�����ش��������⣺
��1�������ε�Ksp
| ������ | Ksp |
| Ca3(AsO4)2 | 6.8��10��19 |
| CaSO4 | 9.1��10��6 |
| FeAsO4 | 5.7��10��21 |
| ��Ⱦ�� | H2SO4 | As |
| ��ˮŨ�� | 29.4g/L | 1.6g��L��1 |
| �ŷű� | pH 6��9 | 0.5mg��L��1 |
 HAsO42��+OH�����ò�ˮ���ƽ�ⳣ����25�棩Ϊ�� ��������λ��Ч���֣���
HAsO42��+OH�����ò�ˮ���ƽ�ⳣ����25�棩Ϊ�� ��������λ��Ч���֣����鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com