

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是
2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是| A.吸收18.4KJ热量 | B.放出73.6KJ热量 |
| C.放出18.4KJ热量 | D.吸收73.6KJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H+ + CN-, K(1)Θ =" 4.9" ×10-10
H+ + CN-, K(1)Θ =" 4.9" ×10-10 NH4+ + OH-, K(2)Θ =" 1.8" ×10-5
NH4+ + OH-, K(2)Θ =" 1.8" ×10-5  H+ + OH-, KwΘ =" 1.0" ×10-14算出NH3 + HCN
H+ + OH-, KwΘ =" 1.0" ×10-14算出NH3 + HCN  NH4+ + CN-, 反应平衡常数的K值是_________________
NH4+ + CN-, 反应平衡常数的K值是_________________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=+567.85kJ·mol-1 |
| B.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85kJ·mol-1 |
| C.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(l) ΔH=+567.85kJ·mol-1 |
| D.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(l) ΔH=-567.85kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
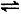 2SO3(g) ?Η=-197kJ/mol。在此温度下,向甲、乙两个固定容积的密闭容器中分别通入2molSO2、1molO2和1mol SO2、0.5molO2,反应达到平衡状态时放出的热量分别为Q甲和Q乙,则下列关系正确的是
2SO3(g) ?Η=-197kJ/mol。在此温度下,向甲、乙两个固定容积的密闭容器中分别通入2molSO2、1molO2和1mol SO2、0.5molO2,反应达到平衡状态时放出的热量分别为Q甲和Q乙,则下列关系正确的是| A.Q乙=0.5Q甲 | B.Q乙< 0.5Q甲 | C.Q乙<Q甲=197kJ | D.Q甲=Q乙<197kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.CH3OH的燃烧热为133.9 kJ·mol-1 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l) +1/2O2(g) = CO2(g) +2H2(g)的DH >-192.9 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com