
工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法类别都正确的是 ( )
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含苯的废水 | 用活性炭吸附 | 物理法 |
| D | 含纯碱的废水 | 加石灰水反应 | 化学法 |
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是( )
A. 无色溶液中:K+、Na+、MnO4-、SO42-
B. 含大量Fe2+溶液中:K+、Cl-、NO3-、Na+
C. 加入Al能放出H2的溶液中:Cl-、NO3-、SO42-、NH4+
D. 在酸性溶液中:NH4+ 、Na+、SiO32-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
298K、10lkPa时,1molH2(g)与O2(g)完全反应生成H2O(g)时放出242kJ热量,而生成H2O(1)时放出286kJ热量,则下列表达不正确的是( )
|
| A. | 2H2(g)+O2(g)=2H2O(g);△H=﹣484kJ•mol﹣1 | B. | H2O(g)=H2(g)+O2(g);△H=242kJ•mol﹣1 |
|
| C. | H2(g)+O2(g)=H2O(1);△H=﹣286kJ•mol﹣1 | D. | H2O(1)=H2O(g);△H=﹣44kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨的反应为N2(g)+3H2(g)⇌2NH3(g).设t℃在容积为2L的密闭容器中充入0.6mol N2和1.6mol H2,反应在一定条件下达到平衡时,NH3的物质的量分数为.计算:
(1)达到平衡时H2的物质的量;
(2)t℃该反应的平衡常数.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列涉及离子方程式书写的评价合理的是 ( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O===CaSO4↓+Cl-+2H+ | 正确 |
| B | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl- | 错误,H+、Cl-的化学计量数应相等 |
| C | 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3(胶体)+3NH | 错误,Fe(OH)3应该是沉淀 |
| D | 铝溶于碳酸中:2Al+3H2CO3===2Al3++3H2↑+3CO | 正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组在网上查阅一种由五种常见短周期元素组成的抗酸药X,信息如表所示;为了探究抗酸药X的成分,兴趣小组设计下列实验。
| 抗酸药X 【药品名称】 X 【规格】 2 g:0.5 g,2 g/袋×20袋/盒 【用法用量】 直接口服或温水冲服,1~2袋/次,3~4次/天。除非另有医嘱,一般成人在餐后1~2小时、睡前或胃不适时服用。病情严重者遵医嘱增加剂量。儿童遵医嘱服用。治疗胃和十二指肠溃疡时,在症状缓解后,至少维持4周。 【适应症】 1.急、慢性胃炎。2.胃、十二脂肠溃疡。3.反流性食管炎。4.与胃酸有关的胃部不适症状,如胃痛、胃灼烧、酸性暖气、饱胀等。5.预防非甾体类药物引起的胃粘膜损伤。 |
取30粒X磨成粉,取一部分粉末加入蒸馏水,粉末不溶解;另取一部分粉末在空气中充分加强热,经检测除产生无色无味气体A外,还生成液态氧化物B和白色固体(C和D混合物),白色固体能部分溶于NaOH溶液。已知B、C、A、D的物质的量之比为12∶6∶1∶1,且式量依次增大,请回答下列问题:
(1)写出A的电子式:________。
(2)写出X的化学式:________。
(3)写出D与氢氧化钠溶液反应的离子方程式:_______________________。
(4)用化学方程式表示X能治疗胃酸过多的原因______________________。
(5)将白色固体溶于足量稀盐酸,再滴加一定量的NaOH溶液得到沉淀Y,请设计实验方案检验Y的成分_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
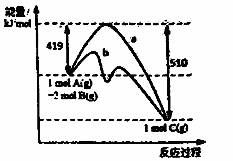
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=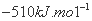
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是 (填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是 。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 。
 ⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 。
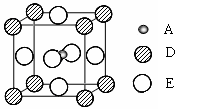
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为 ;该晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜的摩尔质量为M g/mol,密度为ρ g/cm3,阿伏加德罗常数为NA,下列说法正确的是( )
A.1 kg铜所含原子的数目为ρ NA B.一个铜原子所占有的体积为M /(ρNA )cm3
C.一个铜原子的质量为 ρ M / NA g D.1 dm3铜所含有的原子数为 ρ NA / M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com