
��14�֣������ѣ�CH3CH2CH2CH2OCH2CH2CH2CH3����һ�ֻ���ԭ�ϣ�������Ϊ��ɫҺ�壬������ˮ���е�Ϊ142.4�棬�ܶȱ�ˮС��ijʵ��С����������װ�úϳ������ѣ�����װ�þ���ȥ������������Ҫ��ӦΪ��2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
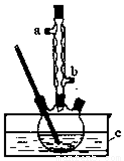
ʵ��������£����ݻ�Ϊ100mL��������ƿ�н�5mLŨ���ᡢ14.8g�������ͼ�����ʯ��Ͼ��ȣ��ټ��Ȼ���һ��ʱ�䣬�ռ����ֲ�Ʒ�����Ƶõ������ѡ��ش��������⣺
��1���ϳɴֲ�Ʒʱ��Һ���Լ�����˳���� ��
��2��ʵ��������ˮӦ�� �ڳ�ȥ���a����b������
��3��Ϊ��֤��Ӧ�¶Ⱥ㶨��135�棬װ��C����ʢҺ�������е���������Ϊ ��
��4������ʱ��������¶ȹ��ߣ���Ӧ���Һ���ڣ�д����NaOH��Һ�����ж�β�������ӷ���ʽ ��
��5���õ��������Ѵֲ�Ʒ������8 mL50%�����ᡢ10 mLˮ��ȡϴ�ӡ��ò�������Ҫ�����ڹ����β��ʵ�ʵ���������ձ����������� ��������ʹ��ǰ��Ҫ ��
��6������������л�������ˮ�Ȼ��Ƹ�����˺��ٽ��� ����������ƣ����Ƶõ������ѡ�
��7����ʵ�����յõ�6.50g�����ѣ��������ѵIJ����� ��
��1���ȼ������������Ũ�����2��a����3����Һ��е����135�棻
��4��2OH-+SO2=SO32-+H2O����5����Һ©���� ��©����6������7��50.0%��
��������
�����������1���ϳɴֲ�Ʒʱ�����ڶ������ܶȱ�����С�����Ҷ���ϻ�ų��������ȣ�����Һ���Լ�����˳�����ȼ������������Ũ�����2��Ϊ��ʹ����Ч�����ã�һ��ʹ�������ڳ���ˮ������ʵ��������ˮӦ���¿�b���룬���Ͽ�a��������3��Ϊ��֤��Ӧ�¶Ⱥ㶨��135�棬װ��C����ʢҺ�������е���������Ϊ��Һ��е����135�棻��4������ʱ��������¶ȹ��ߣ��ᷢ������Ӧ����SO2��CO2��C���ʵȣ���Ӧ���Һ���ڣ�д����NaOH��Һ�����ж�β�������ӷ���ʽ��2OH-+SO2=SO32-+H2O����5���õ��������Ѵֲ�Ʒ������8 mL50%�����ᡢ10 mLˮ��ȡϴ�ӡ��ò�������Ҫ�����ڹ����β��ʵ�ʵ���������ձ���������������Һ©����������ʹ��ǰ��Ҫ����Ƿ�©Һ����6������������л�������ˮ�Ȼ��Ƹ�����˺��ٽ��������Ƶõ������ѡ���7��14.8g�����������ʵ�����14.8g��74g/mol=0.2mol�����ݷ�Ӧ����ʽ��֪����ȫ��Ӧ����Ӧ������0.1mol�������ѣ���Ϊ�����ѵ���Է���������130������0.1mol�������ѵ�������13g,����ʵ�����յõ�6.50g�����ѣ��������ѵIJ����ǣ�6.50g ��13g ����100%=50.0%��
���㣺�������ʵ���ȡ�����ð������ʵĻ�ϡ��������̡�������ѡ����ʹ�á������ķ��롢���ʵļ����֪ʶ��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ܿ��и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڻ�ʯȼ�ϼ���ӹ�˵����ȷ����
A����Ȼ������������Ҫ�ɷֶ��Ǽ��飬���߶��Dz���������Դ
B��ʯ�ͷ����ú�����������仯��ǰ�߿ɵõ����͡�ú�͵ȣ�������Ҫ�õ���̿��ú���͡��ְ�ˮ�ͽ�¯��
C��ʯ���ѻ���Ҫ��Ϊ����������͵IJ��������������͵IJ���
D��ú��Һ��ָ���ǰ�ú���ȵ��۵�����ʹ����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ܿ��и�һ��ѧ��6��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���Ӧ�������仯�ֱ���������ʽ��ʾ��ͼ��ʾ��������ȷ����
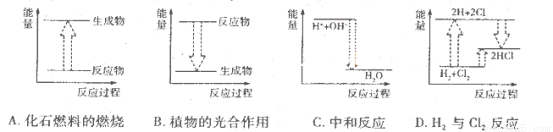
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ܿ��и�һ��ѧ��5��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����пƬ�ʹ�ͭƬ����ͼ��ʾ��ʽ����ͬŨ�ȵ�ϡ������һ��ʱ�䣬����������ȷ����

A.���ձ���ͭƬ����������ݲ��� B.����ͭƬ������������ͭƬ�Ǹ���
C.���ձ�����Һ�����Ծ����� D���������ݵ����ʼױ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ܿ��и�һ��ѧ��5��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���н����У�ͨ�������Ȼ�ԭ��ұ������
A��Na B��Al C��Fe D ��Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����д��ڸ߶���������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�¡�������ͪ�Ǵ�����õ�廨�����ѵ��е�һ����Ȼ���ϣ������ಽ��Ӧ�ɺϳ�ά����A1��

����˵����ȷ����
A���¡�������ͪ��ʹ����KMnO4��Һ��ɫ
B��1mol�м���X�������2molH2�����ӳɷ�Ӧ
C��ά����A1������NaOH��Һ
D���¡�������ͪ���м���X��Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����д��ڸ߶���������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ��Ӧ������ȷ����
A��ʵ������Һ��ͱ��ڴ������������屽��
B����������ʳ�ף�CaCO3��CH3COOH===CH3COOCa��H2O��CO2��
C����CH2BrCOOH�м�������������������Һ�����ȣ�CH2BrCOOH��OH��  CH2BrCOO����H2O
CH2BrCOO����H2O
D����������Һ��ͨ������CO2��CO2��H2O��2C6H5O���D��2C6H5OH��2CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����д��ڸ�һ��������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�Ͷ���Ľṹ��ʽΪCH3��CH=CH��COOH�����Т��Ȼ��⡢����ˮ���۴�����Һ�����Ҵ��������Ը��������Һ���ж���һ�������£�����Ͷ��ᷴӦ��������
A��ֻ�Тڢܢ� B��ֻ�Т٢ۢ� C��ֻ�Т٢ڢۢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�ӱ�ʡ�����и߶�7�µ��п��Ի�ѧ�Ծ��������棩 ���ͣ������
��1����֪:H2(g)+O2(g) H2O(g),��Ӧ�����������仯��ͼ��ʾ����:
H2O(g),��Ӧ�����������仯��ͼ��ʾ����:

����д��a��b��c�ֱ���������壺
a�� ;
b�� ;
c�� ��
�ڸ÷�Ӧ�� ��Ӧ(����ȡ����ȡ�),��H 0(�>����<��)��
��2�����䡰�칬��һ�ŵĻ��ʹ�õ��ƽ�����Һ���Һ��,�����ƽ������ŵ��ǡ�������������,������������������������(��д����)
��3����֪:H2(g)+ O2(g)=H2O(l)����H=-285.8 kJ��mol-1
O2(g)=H2O(l)����H=-285.8 kJ��mol-1
H2(g)==H2(l)����H=-0.92 kJ��mol-1
O2(g)==O2(l)����H=-6.84 kJ��mol-1
H2O(l)=H2O(g)����H=+44.0 kJ��mol-1
��д��Һ���Һ��������̬ˮ���Ȼ�ѧ����ʽ: ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com