
| A、加热 |
| B、两者分别与同浓度的稀盐酸反应 |
| C、溶于水,比较其溶解性 |
| D、两者分别加入NaOH溶液或石灰水 |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| Ⅰ | Ⅱ | Ⅲ | |
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 13.8g | 14.2g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A、根据表中第Ⅱ组数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、盐酸的物质的量浓度为3.0mol?L-1 |
| D、13.8g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有SO42- |
| B、一定含有Ag+ |
| C、一定不含CO32- |
| D、可能含有SO42-或Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最终得到的溶液中:C(Na+)=C(Cl-)+C(OH-) |
| B、反应过程中得到标准状况下气体的体积为7.84L |
| C、最终得到C(Na+)=1.5mol/L |
| D、最终得到沉淀为Al(OH)3,质量是7.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
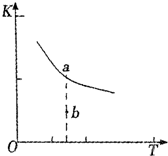 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.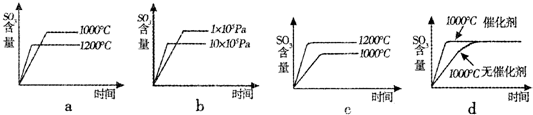
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 |
| B、含磷洗衣粉中的磷是植物生长的营养元素,洗衣水可排入河泊 |
| C、在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 |
| D、国家规定商家不得无偿提供塑料袋,是为了减少白色污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com