
A、硫原子的原子结构示意图: | ||
B、NH3分子的电子式: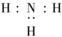 | ||
C、原子核内有8个中子的氧原子:
| ||
| D、氮气的结构式:N≡N |
 ,故A错误;
,故A错误; ,故B错误;
,故B错误; ,将共用电子对换成短线即为氮气的结构式,所以氮气的结构式为:N≡N,故D正确;
,将共用电子对换成短线即为氮气的结构式,所以氮气的结构式为:N≡N,故D正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
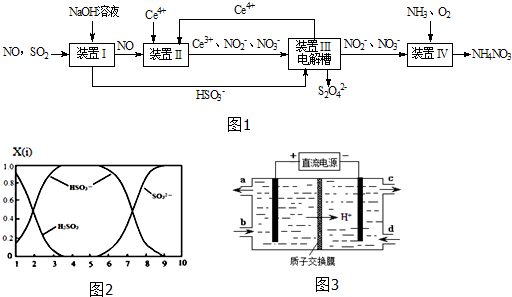
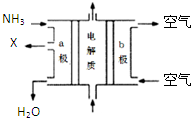 工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.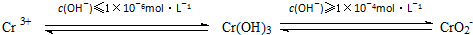
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素化合价发生变化(升高和降低)的反应一定是氧化还原反应 |
| B、在氧化还原反应中一定发生电子转移(电子得失或电子对偏移) |
| C、氧化还原反应一定有氧参加 |
| D、氧化反应和还原反应是同时发生的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、着色剂_______苯甲酸钠 |
| B、调味剂_______食盐 |
| C、营养强化剂_______亚硝酸钠 |
| D、防腐剂_______苋菜红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中溶液全部加热蒸干 |
| B、蒸馏操作时,应将温度计水银球置于蒸馏烧瓶的支管口附近 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、使用容量瓶和分液漏斗前,要先检查是否漏水后使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、玛瑙的主要成分是硅酸盐 |
| B、晶体硅和二氧化硅晶体都常用来制造电子部件 |
| C、硅和二氧化硅都不与酸反应 |
| D、硅和二氧化硅都广泛存在于自然界中,天然单质硅叫硅石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com