
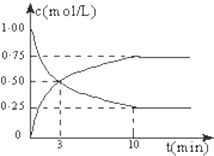
 在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示:
在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示:| n(CH3OH) |
| n(CO2) |
| 4,5mol |
| 5mol |
| 0.75×0.75 |
| 0.25×0.253 |
| 0.8×0.8 |
| 1×0.43 |


科目:高中化学 来源: 题型:
| A、Ba2+、Cl-、SO42-、K+ |
| B、Mg2+、SO42-、Na+、Cl- |
| C、H+、CO32-、Al3+、Cl- |
| D、K+、Fe2+、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/浓度 | c(NH3)(mol?L-1) | c(O2)(mol?L-1) | c(NO)(mol?L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A、反应在第2min到第4min时,O2的平均速率为0.1875mol?L-1?min-1 |
| B、反应在第2min时改变了某一条件,该条件可能是使用催化剂或升高温度 |
| C、第4min、第8min时分别达到化学平衡,且平衡常数相同 |
| D、在开始反应的前2min内,该反应放出0.05QKJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 测定同浓度的Na2CO3和Na2SO4溶液pH,前者大于后者 | 碳元素非金属性弱于硫 |
| B | 铝箔在酒精灯火焰上加热熔化不滴落 | 金属铝的熔点非常高 |
| C | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变红色 | 该Fe(NO3)2试样已经变质 |
| D | 将滴有稀硫酸的淀粉液加热后加入新制的Cu(OH)2加热,没有红色沉淀 | 淀粉在该条件下不水解 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com