
【题目】下列属于酸式盐的是
A. NH4Cl B. NaHCO3 C. H2O2 D. NaH
科目:高中化学 来源: 题型:
【题目】标准状况下将44.8LHCl气体溶于1L水中,所得盐酸溶液的密度为1.1g/cm3,该盐酸的物质的量浓度为
A. 2mol/L B. 2.1mol/L C. 2.2mol/L D. 2.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
还到平衡的时间/min | 5 | 8 | |
A的浓度/mol L-1 | cl | c2 | O |
C的体积分数/% | ω1 | ω3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是
A. 若x<4,则2c1<c2
B. 若x=4,则ω1=ω3
C. 无论x的值是多少,均有2ρ1=ρ2内
D. 容器甲中反应从开始到平衡的平均反应速率可能为v(A)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做浓度对化学反应速率的影响的实验时,将3支试管分别编号为①②③,并按下表中物质的量进行实验,记录下的时间数据是16 s、28 s、33 s。请将3个数据填入下面的适当位置,并写出实验结论。

(1)将对应①、②、③的时间分别写出:
(a)________,(b)________,(c)________。
(2)实验结论:______________________________________________。
(3)写出反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答:
(1)物质B、E和F的化学式为B、E、F;
(2)反应①的化学方程式为: , 其反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:
c(Na+)=c(SO4-)>c(NH4+)>c(H+)>c(OH-)
B. 25℃时,0.1mol L-1的HA溶液中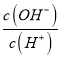 = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若1摩尔C2H2气体完全燃烧生成液态水和CO2气体时放热1299kJ,则乙炔的燃烧热__________热化学方程式是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 在100 mL 1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
B. 在100 mL 2 mol·L-1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2===4Fe3++3I2+10Cl-
C. 向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO![]() +4OH-===Mg(OH)2↓+2CO
+4OH-===Mg(OH)2↓+2CO![]() +2H2O
+2H2O
D. 向NH4Al(SO4)2溶液中加入Ba(OH)2恰好使SO![]() 反应完全2Ba2++4OH-+Al3++2SO
反应完全2Ba2++4OH-+Al3++2SO![]() =2BaSO4↓+AlO
=2BaSO4↓+AlO![]() +2H2O
+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com