
【题目】图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
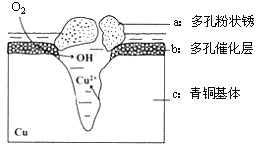
(1) 腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
(2) 环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 ;
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标况)。
【答案】(1)c;
(2)2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)0.448。
【解析】
试题分析:(1)根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)n[Cu2(OH)3Cl]=![]() =0.02mol,根据转移电子得n(O2)=
=0.02mol,根据转移电子得n(O2)=![]() =0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,故答案为:0.448。
=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,故答案为:0.448。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列关于如图所示各装置的叙述正确的是

A.装置①是原电池,总反应式是Cu+2Fe3+= Cu2++2Fe2+
B.装置①中,铁作正极,正极反应式为Fe3++e-= Fe2+
C.装置②可以减缓铁棒的腐蚀,此保护方法为牺牲阳极的阴极保护法
D.若用装置③精炼铜,则c极为粗铜,d极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______。
(2)证明AgNO3溶液加过量的实验方是_____________________________________________ 。(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:_________________________________ (填编号字母)。
(2)从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有______ 处。
(3)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4;2NaCl+H2SO4![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S;Na2SO4+4C![]() Na2S+4CO↑
Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3;Na2S+CaCO3![]() Na2CO3+CaS
Na2CO3+CaS
下列说法正确的是( )
A.②③两步都是氧化还原反应
B.只有第②步是氧化还原反应
C.该方法对生产设备基本没有腐蚀
D.该方法对环境污染较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.5%,则能与NaOH溶液发生反应的X的同分异构体有(不考虑立体异构)( )
A. 15种B. 14种C. 13种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.能自发进行的反应一定能迅速发生
B.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为判断反应能否自发进行的判据
D.反应2N2(g)+O2(g)=2N2O(g) ΔH=+163 kJ·mol-1在高温下可以自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的现象是_________________________________________。
②Y电极上的电极反应式为___________________________________。
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是_______,电极反应式为__________________________。
②Y电极的材料是_______
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是_____________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因________________。
③除去杂质后的氢氧化钾溶液从溶液出口________(填写“A”或“B”)导出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为1 molSO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ·mol-1、E2=y kJ·mol-1,下列有关说法中不正确的是( )
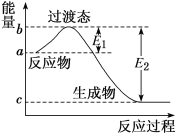
A.若在反应体系中加入催化剂,E1减小
B.若在反应体系中加入催化剂,ΔH不变
C.反应的活化能等于x kJ·mol-1
D.2SOCl2(g)=SO2Cl2(g)+SCl2(g) ΔH=(x-y)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com