
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɣ���ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼ1װ����һ�������N��C��Si���ַǽ���Ԫ�صķǽ�����ǿ���Ƚϵ�ʵ���о�����ͬѧ�������ͼ2װ������֤±��Ԫ�����ʵĵݱ���ɣ�ͼ2�У�A,B,C�����ֱ���մ��NaBr��Һ������ʪ��ĵ���KI��ֽ��ʪ���ֽ����֪������Ũ�������������ܷ�Ӧ����������
��1����ͬѧʵ�飨��ͼ1����ѡ�õ������������Ʒֱ�Ϊ���� 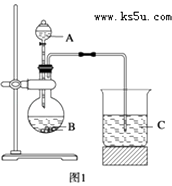
��2����ͬѧʵ�飨��ͼ2���У�A����Ӧ�����ӷ���ʽΪ���� B����ʵ������Ϊ������ʵ�鲻����ȫ֤��±�����ʵĵݱ���ɣ������ԭ�� �� 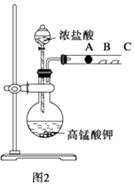
���𰸡�
��1��AΪϡ���ᣬBΪ̼��ƻ�̼�ᱵ��CΪ�����ƻ�������Һ
��2��Cl2+2Br��=Br2+2Cl������ֽ���������������͵⻯�ط�Ӧ�û����ⵥ�ʣ�Ҳʹ���۵⻯����ֽ����������֤����Ԫ�طǽ�����ǿ�ڵ�Ԫ��
���������⣺��1�����������Ϣ����ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼ1װ����һ�������ͬ����Ԫ�طǽ�����ǿ���Ƚϵ�ʵ���о������������ǿ��̼�ᣬ̼������ǿ�ڹ��ᣬ����������Ӧˮ��������Խǿ����ԭ�ӵķǽ�����Խǿ������AΪϡ���ᣬBΪ̼��ƻ�̼�ᱵ��CΪ�����ƻ�������Һ�����Դ��ǣ�AΪϡ���ᣬBΪ̼��ƻ�̼�ᱵ��CΪ�����ƻ�������Һ����2��A,B,C�����ֱ���մ��NaBr��Һ������ʪ��ĵ���KI��ֽ��ʪ���ֽ���������������ԣ��ܽ������ӡ�����������Ϊ��Ӧ�ĵ��ʣ���A����Ӧ�����ӷ���ʽΪ��Cl2+2Br��=2Cl��+Br2��B�������������������ɵⵥ�ʣ���Ӧ�����ӷ���ʽΪ��Cl2+2I��=2Cl��+I2 �� ����B��������Ϊ��ֽ�����������������ܹ����ⵥ�������ɵⵥ�ʣ��Ӷ�ʹ���۵⻯����ֽ�����������˼�����������֤����Ԫ�طǽ�����ǿ�ڵ�Ԫ�أ����Դ��ǣ�Cl2+2Br��=Br2+2Cl������ֽ���������������͵⻯�ط�Ӧ�û����ⵥ�ʣ�Ҳʹ���۵⻯����ֽ����������֤����Ԫ�طǽ�����ǿ�ڵ�Ԫ�أ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪԪ�����ڱ���һ���֣�
�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | |
һ | �� | |||||||
�� | �� | �� | �� | �� | �� | |||
�� | �� | �� | �� | �� | ||||
�� | ||||||||
��1������Ԫ���ķǽ�������ǿ��Ԫ���Ľ�������ǿ��Ԫ���ĵ��������³�Һ̬����дԪ�ط��ţ���
��2������Ԫ�آߵ�ԭ�ӽṹʾ��ͼΪ
��3������Ԫ�آޢ��⻯����ȶ���˳��Ϊ������д��ѧʽ����ͬ����
��4������Ԫ�آ������������Ӧˮ��������ԣ��� ��
��5������Ԫ�آں͢�����������Ӧˮ����ļ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йض������ȼ��飨CF2Cl2����������ȷ����
A.�ǷǼ��Է���B.�����������ͷ���
C.ֻ��һ�ֽṹD.�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������İ�������粒����������Ƶ�������������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ��NH2COONH4(s) ![]() 2NH3(g)+CO2(g)���������¶Ⱥ�����������䣬�ٳ���n (NH3): n (CO)=2:1,���ٴδﵽƽ��ʱc (NH3)
2NH3(g)+CO2(g)���������¶Ⱥ�����������䣬�ٳ���n (NH3): n (CO)=2:1,���ٴδﵽƽ��ʱc (NH3)
A. ���� B. ���� C. ��С D. �������������ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д������( )
A.������ͨ��������ͨˮ���ԭ���ж�����ʯ��ʯ
B.�����մɺ���ͨ������ԭ���ж�����ʯӢ
C.ijЩ�ϳ������������ϼ�����Ҫԭ��
D.����ˮ�����Ͳ�����ԭ���ж������ռ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2)����ɫ�д̼�����ζ��Һ�����۵�Ϊ-54.1�����е�Ϊ69�����ڳ�ʪ������������������ʵ��������SO2(g)��Cl2(g)�ϳ������ȵ�ʵ��װ������ͼ��ʾ(���ּг�װ����ʡ��):

�ش���������:
��1��ʵ�����Ʊ����﴿��������������A��B��Cװ���������������װ�ýӿ�:a��___��____��___��______��f(��������������;��Сдѧĸ��ʾ)��
��2��ʵ������У�ʹ�÷�Һ©���μ�Ũ����IJ�����_____________��
��3��װ��C��������____________��װ��B��F��Ũ�����������Ǣ�____________���ڿɹ۲쵽____________(������)����ӳͨ����������ʣ����÷�ӦҺ�μӵĿ���������ͨ�����ʼ��Կ��ƣ��Ӷ�ʹͨ�뷴Ӧ����SO2��Cl2�ﵽ��ѷ�Ӧ������
��4����װ�ô������Ե�ȱ������ָ��:________________��
��5����֪�÷��ϳ�������Ϊ���淴Ӧ��ÿ����2.7g�����ȷų�����1940J��д���÷�Ӧ���Ȼ�ѧ����ʽ: ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������ȵ�����ͭ��Ӧ�õ������ͽ���ͭ����ͼ�е�װ�ÿ���ʵ�ָ÷�Ӧ�� 
��1���Թ�A�з�����Ӧ�Ļ�ѧ����ʽ����
��2��װ��B����ƿ���Լ���ѡ��������ţ��� a����ʯ�ҡ�b��Ũ���ᡡc�����������ס�d����ˮ�Ȼ���
��3��װ��C��ʢװ����������ʵ��ʱ��C�й۲쵽����������
��4��C�з����Ļ�ѧ��Ӧ����ʽ����
��5�������ʵ��������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A.���Ȼ�������Һ��ͨ��������Fe2++Cl2=Fe3++2Cl-
B.��NaAlO2��Һ��ͨ�����CO2��2AlO2-+CO2+3H2O=2Al(OH)3��+CO32-
C.̼��������Һ������������Һ��Ӧ��HCO3-+H+=CO2��+H2O
D.��������Һ�м��������ˮ: Al3++3OH-=Al(OH)3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�Ӧ2AB(g)![]() A2(g)��B2(g)�ﵽƽ��״̬�ı�־��
A2(g)��B2(g)�ﵽƽ��״̬�ı�־��
A. ��λʱ��������nmolA2��ͬʱ����2n molAB
B. �����ڣ�3������AB��A2��B2����
C. AB���������ʵ���A2����������
D. �����и���ֵ������������ʱ��仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com