
【题目】下列物质的化学性质与实际应用对应关系正确的是( )
化学性质 | 实际应用 | |
A | NH3具有碱性 | 用作制冷剂 |
B | SO2是酸性氧化物 | 用于纸张漂白 |
C | 漂白粉具有氧化性 | 用于漂白织物 |
D | FeCl3能与碱溶液反应 | 用于蚀刻铜制线路板 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,有关判断正确的是( )
①Zn+2HCl ![]() ZnCl2+H2↑;②NaOH+HCl
ZnCl2+H2↑;②NaOH+HCl ![]() NaCl+H2O;
NaCl+H2O;
③2HCl ![]() H2↑+Cl2↑
H2↑+Cl2↑
选项 | 有关判断 |
A | 反应①是置换反应,HCl表现还原性 |
B | 反应②是复分解反应,HCl表现氧化性 |
C | 反应③中HCl既表现氧化性也表现还原性 |
D | 反应①中氢原子失去电子 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1△H2 .
①P4(白磷,s)+5O2(g)═2P2O5(s)△H1
②4P(红磷,s)+5O2(g)═2P2O5(s)△H2
(2)已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJmol﹣1 , 则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量57.3kJ.
(3)已知:C3H8(g )═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJmol﹣1
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=32.4kJmol﹣1
则相同条件下,反应C3H8(g)═CH3CH=CH2 (g)+H2(g)的△H=kJmol﹣1
(4)如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx . 该电池正极的电极反应式为 .
用该电池作电源进行铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为g.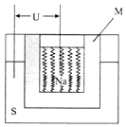
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol A与2mol B混合于2L的密闭容器中反应:2A(g)+3B(g)2C(g)+zD(g)若2s后,A的转化率为50%,测得v(D)=0.25molL﹣1s﹣1 , 下列推断正确的是( )
A.v(C)=0.2 molL﹣1s﹣1
B.z=3
C.B的转化率为25%
D.C的体积分数为28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取钠﹣镁合金7.0克进行如下实验:
(1)写出Mg在CO2中燃烧的化学方程式
(2)向溶液1中加过量的NaOH溶液,发生反应的离子方程式为
(3)写出合金的化学组成 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJmol﹣1
③ ![]() H2SO4(1)+NaOH(1)═
H2SO4(1)+NaOH(1)═ ![]() Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
⑤CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283kJmol﹣1
O2(g)═CO2(g)△H=﹣283kJmol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJmol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJmol﹣1
(1)上述热化学方程式中,不正确的有 , 不正确的理由分别是 .
(2)根据上述信息,写出C转化为CO的热化学方程式: .
(3)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位.炼铁高炉中发生的关键反应如下:
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ ![]() O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的燃烧热为;写出其热化学方程式 .
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为 .
(3)炼制1t(吨)含铁96%的生铁所需焦炭的理论用量是t(结果保留两位有效数字),实际生产中所需焦炭远高于理论用量,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别滴加相同浓度盐酸30.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如表.
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2的体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中物质的量之比n(Na2CO3):n(NaHCO3)=;
(2)盐酸的物质的量浓度c(HCl)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有一定量NaOH溶液的烧杯中通入不同的CO2气体,再在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图:(忽略CO2的溶解和HCl的挥发) 
则下列分析都正确的组合是( )
①Ⅰ图对应溶液中的溶质为NaHCO3
②Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3 , 且二者的物质的量之比为1:1
③Ⅲ图对应溶液中的溶质为NaOH和NaHCO3 , 且二者的物质的量之比为1:1
④Ⅳ图对应溶液中的溶质为Na2CO3 .
A.①②
B.①③
C.②④
D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com