
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:下列说法错误的是
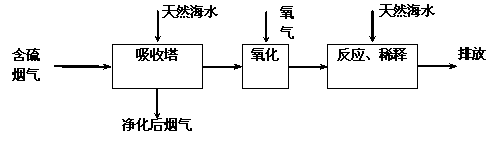
A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 下列说法错误的是( )
下列说法错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
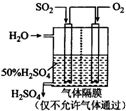 硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+
硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示,下列说法错误的是( )
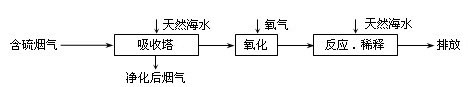
A.天然海水pH ≈ 8的原因是由于海水中的CO32-、HCO3-水解![]()
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-![]()
C.“反应.稀释”时加天然海水的目的是中和.稀释经氧化后海水中生成的酸![]()
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示,下列说法错误的是( )
A.天然海水pH ≈ 8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应.稀释”时加天然海水的目的是中和.稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源:浙江省五校2009-2010学年度高三第一次联考(化学)试题 题型:选择题
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示,下列说法错误的是( )
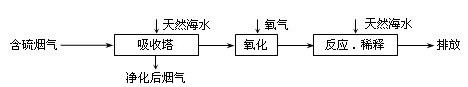
A.天然海水pH ≈ 8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应.稀释”时加天然海水的目的是中和.稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com