
����Ŀ��ijNa2CO3��NaAlO2�Ļ����Һ����μ���1 mol/L�����ᣬ�����Һ��CO32-��HCO3-��AlO2-��Al3�������ʵ��������������Һ������仯��ϵ��ͼ��ʾ��������˵����ȷ����( )

A��a���߱�ʾ�����ӷ���ʽΪAlO2-��H����H2O==Al(OH)3��
B��ԭ�����Һ�е�CO32-��AlO2-�����ʵ���֮��Ϊ1��2
C��V1��V2��l��5
D��M��ʱ���ɵ�CO2Ϊ0��05 mol
���𰸡�A
��������
���������Na2CO3��NaAlO2�Ļ����Һ����μ���1molL-1��������ȣ�������ӦAlO2-+H++H2O�TAl(OH)3����a�߱�ʾAlO2-����ͼ��֪AlO2-��Ӧ��ϣ���������50mL�����ݷ���ʽ��֪n(AlO2-) = n(H+) = 0.05 L �� 1 mol/L = 0.05mol���ڶ��Σ�AlO2-��Ӧ��ϣ�������ӦCO32-+H+�THCO3-��b�߱�ʾCO32-��c�߱�ʾHCO3-����ͼ��֪CO32-��Ӧ��ϣ��ýμ�������100mL-50mL=50mL�����ݷ���ʽ��֪n(CO32-)=n(H+)=0.05L��1mol/L=0.05mol�������Σ�CO32-��Ӧ��ϣ�������ӦHCO3-+H+�TCO2��+H2O��d�߱�ʾHCO3-����ͼ��֪HCO3-��Ӧ��ϣ��ýμ�������150mL-100mL=50mL�����ݷ���ʽ��֪n(HCO3-)=n(H+)�����ĽΣ�������ӦAl(OH)3+3H+�TAl3++3H2O��e�߱�ʾAl3+����ͼ��֪Al(OH)3��Ӧ��ϣ����ݷ���ʽ��֪n(H+)=3n[Al(OH)3]=3��0.05mol=0.15mol���ýμ����������Ϊ![]() =0.15L=150mL��B��������������֪��ԭ�����Һ�е�CO32-��AlO-2�����ʵ���֮��Ϊ0.05mol��0.05mol=1��1����B����C��ԭ��Һ��n(CO32-)=0.05mol��V1ʱ��Һ��̼��������ӵ���̼�������Ϊ0.025ml���ɷ�ӦCO32-+H+�THCO3-��֪����Ҫ����Ϊ0.025mol����������Ϊ
=0.15L=150mL��B��������������֪��ԭ�����Һ�е�CO32-��AlO-2�����ʵ���֮��Ϊ0.05mol��0.05mol=1��1����B����C��ԭ��Һ��n(CO32-)=0.05mol��V1ʱ��Һ��̼��������ӵ���̼�������Ϊ0.025ml���ɷ�ӦCO32-+H+�THCO3-��֪����Ҫ����Ϊ0.025mol����������Ϊ![]() =0.025L=25mL����V1=50mL+25mL=75mL��������������֪��V2=150mL+150mL=300mL����V1��V2=75mL��300mL=l��4����C����D��������������֪M��ʱ��Һ��CO32-��ȫת��ΪHCO3-��û��CO2���ɣ���D����A��������������֪��a���߱�ʾ�����ӷ���ʽΪ��AlO-2+H++H2O=Al(OH)3������A��ȷ����ѡA��
=0.025L=25mL����V1=50mL+25mL=75mL��������������֪��V2=150mL+150mL=300mL����V1��V2=75mL��300mL=l��4����C����D��������������֪M��ʱ��Һ��CO32-��ȫת��ΪHCO3-��û��CO2���ɣ���D����A��������������֪��a���߱�ʾ�����ӷ���ʽΪ��AlO-2+H++H2O=Al(OH)3������A��ȷ����ѡA��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ�Ļ���ԭ��A��C2H2���ϳ��л���E��![]() ��·����ͼ��ʾ�����ַ�Ӧ������������ȥ������D��һ�������¿ɱ�������ͪ��
��·����ͼ��ʾ�����ַ�Ӧ������������ȥ������D��һ�������¿ɱ�������ͪ��
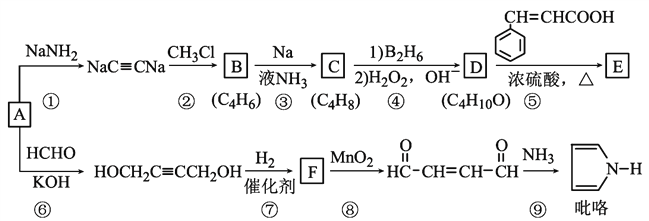
�ش��������⣺
��1��B��ϵͳ������______����֪C��˳ʽ�����C�Ľṹ��ʽΪ_______________��
��2���ݵķ�Ӧ������_________________��E���еĹ����ŵ�������________________��
��3����Ӧ�����������Cu(OH)2�Ļ�ѧ����ʽΪ____________________��
��4������������������ᣨ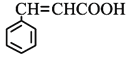 ����ͬ���칹�干____�֣������к��б�����̼̼˫�����ܹ�����������Ӧ����FeCl3��Һ����ɫ��д�����к˴Ź�������ͼ������壬�ҷ����֮��Ϊ1:1:1:1:2:2�Ľṹ��ʽ____________________
����ͬ���칹�干____�֣������к��б�����̼̼˫�����ܹ�����������Ӧ����FeCl3��Һ����ɫ��д�����к˴Ź�������ͼ������壬�ҷ����֮��Ϊ1:1:1:1:2:2�Ľṹ��ʽ____________________
��5�����������ϳ�·�ߣ����һ���ɱ�Ȳ�ͼ�ȩΪ��ʼԭ���Ʊ�![]() �ĺϳ�·��__________________________��
�ĺϳ�·��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С����ʹ������к͵ζ����ⶨij���۰״�������(g/100 mL)��
��.ʵ�鲽�裺��1����________(����������)��ȡ10.00 mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100 mL����ƿ�ж��ݣ�ҡ�ȼ��ô���״���Һ��
![]()
��2������ʽ�ζ���ȡ����״���Һ20.00 mL����ƿ�У������еμ�2��______��ָʾ����
��3����ȡʢװ0.1000 mol��L��1 NaOH ��Һ�ļ�ʽ�ζ��ܵij�ʼ���������Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ________mL��
��4���ζ��� ���������һ����Һ��Һ������ɫ��Ϊdz��ɫ����30�����ޱ仯ʱ��ֹͣ�ζ�������¼NaOH��Һ���ն������ظ��ζ�3�Ρ�
��.ʵ���¼��
�ζ�����ʵ������(mL) | 1 | 2 | 3 | 4 |
V(��Ʒ) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(����) | 15.95 | 15.00 | 15.05 | 14.95 |
��.���ݴ��������ۣ�
��1����ʵ���������ݣ����۰״���������________g/100 mL��
��2���ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�����________(��д���)��
a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ��������������Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫ����ǿУ.�����е�һ��ѧ2017�������ѧ�ڵ�һ���¿��������£���10mL0.1mol��L-1��HR��Һ������0.1mol��L-1��NH3��H2O��Һ��������ҺpH�����������仯��ͼ�����з�������ȷ����

A. a��b�㵼��������ǿ��˵��HRΪ����
B. b����ҺpH=7,��ʱ���ǡ���к�
C. b��c����ˮ�ĵ���̶ȣ�b<c
D. c����Һ����c(NH4+)>c(R-)��c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A���������Ļ�ȡ��Ҫ����ú�ĸ���Ͷ�ʯ�ͷ����Ʒ�Ĵ�����
B��������ת��Ϊ�춡��һ���������仯
C��ʯ�͵Ĵ��ѻ���ҪĿ�����������Һ��ȼ�ϵIJ������������͵IJ���
D��ʯ�͵ij�ѹ�����ܵõ����͡�ʯ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(TiCl4)����ȡ���칤ҵ���ϡ����ѺϽ����Ҫԭ�ϡ�ʵ������TiO2��CCl4Ϊԭ����ȡҺ̬TiCl4��װ����ͼ��ʾ�����ּг�װ��ʡ�ԣ���
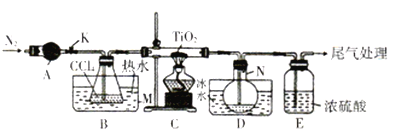
��֪���й����ʵ��������±���
���� | �۵�/�� | �е�/�� | ���� |
CCl4 | -23 | 76 | ��TiCl4���� |
TiCl4 | -25 | 136 | ����ʪ����������������550 ��ʱ�ܱ��������� |
��ش��������⣺
��1������A��������________������A��ʢװ���Լ���___________��
��2��CCl4�ĵ���ʽΪ__________��
��3��װ��C��Ӳ�ʲ����з�Ӧ�Ļ�ѧ����ʽΪ__________________��
��4��TiCl4����ʪ���������TiO2����Ӧ�Ļ�ѧ����ʽΪ________________��
��5������N���ռ�����������Ҫ��___________��д��ѧʽ�����Ӳ����з����TiCl4��ʵ�鷽����_____________��
��6��TiCl4������TiO2����̿�������ڼ����������Ƶã����������Ϊ2��1��CO��CO2������壬�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________�������ʵ�鷽����֤������������CO:_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼��ѧ���о��ڹ�ҵ�����о�����Ҫ���塣
(1)��һ���¶Ⱥ�ѹǿ�£���֪��
��ѧ�� | C��H | C��O | O��H | C=O | O=O | C��C |
����(kJ��mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
��CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g)��H1=____________��
CH3CHO(g)+H2O(g)��H1=____________��
����2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)��Ӧ���Է����У�
2CH3COOH(g)��Ӧ���Է����У�
��CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g)��H2_____0(�>������<����=��)��
CH3COOH(g)+H2O(g)��H2_____0(�>������<����=��)��
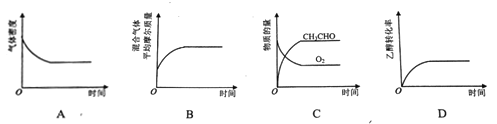
(2)��һ����CH3CH2OH��O2������¡���ѹ�ܱ������У�������Ӧ2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)��ƽ��״̬������ͼ��������_________��
2CH3CHO(g)+2H2O(g)��ƽ��״̬������ͼ��������_________��
(3)��֪��25�棬Ka(CH3COOH)=1.75��10-5��Kb(NH3��H2O)= 1.75��10-5�� ![]() ��1.3��lgl.3��0.1
��1.3��lgl.3��0.1
��25�棬0.lmol��L-1CH3COOH ��Һ��pH =______����0.1 mol��L-1CH3COOH��Һ��0.1mol��L-1�İ�ˮ�������ϣ�������Һ������Ũ�ȴ�С��ϵΪ__________________��
��25�棬0.2 mol��L-1NH4Cl��Һ��NH4+ˮ�ⷴӦ��ƽ�ⳣ��Kh=_____ (����2λ��Ч����)��
��25�棬��0.1 mol��L-1��ˮ�м�������NH4Cl���壬NH3��H2O![]() NH4+ + OH-�ĵ���ƽ��_______������������桱���ߡ��������ƣ����ð�ˮ��ij����Σ������Լ�����Ʒ��ѡ)�����һ��ʵ��֤��NH3��H2O���������___________��
NH4+ + OH-�ĵ���ƽ��_______������������桱���ߡ��������ƣ����ð�ˮ��ij����Σ������Լ�����Ʒ��ѡ)�����һ��ʵ��֤��NH3��H2O���������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D����ǿ����ʣ�������ˮ�е��������������(ÿ������ֻ��һ���������һ����ظ�)��
������ | Na����Ba2����NH |
������ | CH3COO����OH����Cl����SO |
��֪����A��C��Һ��pH������7��A��B����Һ��ˮ�ĵ���̶���ͬ����C��Һ��D��Һ����ʱֻ���ɰ�ɫ������B��Һ��C��Һ����ʱֻ���ɴ̼�����ζ�����壬A��Һ��D��Һ���ʱ������
(1)A��_____________��B��____________(�ѧʽ) �������ӷ���ʽ��ʾA��ˮ��Һ�д��ڵ�ƽ���ϵ�� ��
(2)25 ��ʱ��0.1 mol��L��1 B��Һ��pH��a����B��Һ�У�c(H��)��c(OH��)��_____________(����Ũ�ȷ���)=_____________(�ú���a�Ĺ�ϵʽ��ʾ)��
(3)��������������ʵ���Ũ�ȵ�B��Һ��C��Һ��ϣ���Ӧ����Һ�и�������Ũ���ɴ�С��˳����_____________��
(4)��һ�������0.005 mol��L��1��C��Һ�У�����һ�������0.00125 mol��L��1�����ᣬ�����Һ��pH��11������Ӧ����Һ���������C��Һ����������֮�ͣ���C��Һ��������������_ _____��
(5)�ڻ�ѧ�����в���K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ��Cl������Ag+��CrO42����ש��ɫ������ָʾ����ζ��յ㡣����Һ��Clǡ�ó�����ȫ(Ũ�ȵ���1.0��105 mol��L1)ʱ����Һ��c(Ag+)Ϊ_______ mol��L1����ʱ��Һ��c(CrO42)����__________ mol��L1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010)��
(6)��ʹ������к͵ζ����ⶨ���Ũ�ȡ��ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ����� (��д���)��
a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м����������Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com