
【题目】以重要的化工原料A(C2H2)合成有机物E和![]() 的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
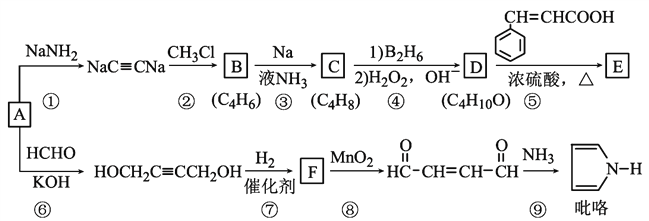
回答下列问题:
(1)B的系统命名是______;已知C是顺式产物,则C的结构简式为_______________。
(2)⑤的反应类型是_________________,E含有的官能团的名称是________________。
(3)反应⑧产物与新制Cu(OH)2的化学方程式为____________________。
(4)符合下列条件肉桂酸(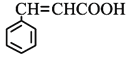 )的同分异构体共____种,分子中含有苯环和碳碳双键,能够发生银镜反应,遇FeCl3溶液显紫色,写出其中核磁共振氢谱图有六组峰,且峰面积之比为1:1:1:1:2:2的结构简式____________________
)的同分异构体共____种,分子中含有苯环和碳碳双键,能够发生银镜反应,遇FeCl3溶液显紫色,写出其中核磁共振氢谱图有六组峰,且峰面积之比为1:1:1:1:2:2的结构简式____________________
(5)参照上述合成路线,设计一条由丙炔和甲醛为起始原料制备![]() 的合成路线__________________________。
的合成路线__________________________。
【答案】 2-丁炔 ![]() 加成反应 碳碳双键酯基
加成反应 碳碳双键酯基 ![]() 16种 HO—
16种 HO—![]() — CH=CHCHO
— CH=CHCHO ![]()
【解析】试题分析:A分子式为C2H2,A是乙炔;根据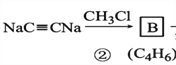 ,可推出B是CH3C
,可推出B是CH3C![]() CCH3;由
CCH3;由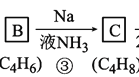 ,可知C是CH3C
,可知C是CH3C![]() CCH3;由CH3C
CCH3;由CH3C![]() CCH3生成D(C4H10O),D在一定条件下可被氧化成酮,D是CH3CH2CHOHCH3;
CCH3生成D(C4H10O),D在一定条件下可被氧化成酮,D是CH3CH2CHOHCH3;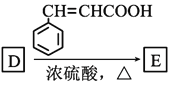 ,E是酯类,结构简式为
,E是酯类,结构简式为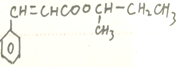
根据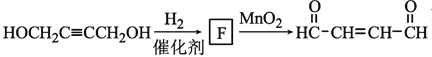 ,可知F是HOCH2CH=CHCH2OH。
,可知F是HOCH2CH=CHCH2OH。
解析:根据以上分析,(1)B是CH3C![]() CCH3,系统命名是2-丁炔;已知C是CH3C
CCH3,系统命名是2-丁炔;已知C是CH3C![]() CCH3, C顺式结构简式为
CCH3, C顺式结构简式为![]() 。
。
(2)![]()
![]() +H2O的
+H2O的
反应类型是取代反应(酯化反应),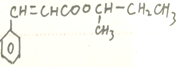 含有的官能团的名称是碳碳双键、酯基。
含有的官能团的名称是碳碳双键、酯基。
(3)反应⑧产物属于醛类,与新制Cu(OH)2反应生成酸和砖红色氧化亚铜,化学方程式为![]() 。
。
(4),分子中含有苯环和碳碳双键,能够发生银镜反应,说明含有醛基,遇![]() 溶液显紫色,说明含有酚羟基,符合条件肉桂酸(
溶液显紫色,说明含有酚羟基,符合条件肉桂酸(![]() )的同分异构体有
)的同分异构体有 (包括邻、间、对3种)、
(包括邻、间、对3种)、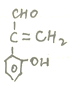 (包括邻、间、对3种)、
(包括邻、间、对3种)、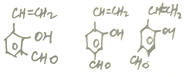 、
、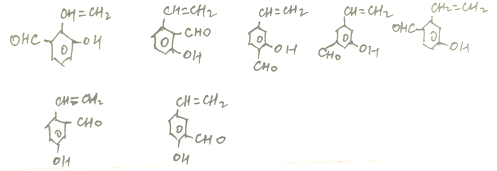
共16种,其中核磁共振氢谱图有六组峰,且峰面积之比为1:1:1:1:2:2的结构简式HO—![]() — CH=CHCHO
— CH=CHCHO
(5)根据上述合成路线,由丙炔和甲醛为起始原料制备![]()
的合成路线![]() 。
。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素的原子序数依次增大。A和C,B和E同主族,C、D、E同周期。由A、B组成的两种化合物甲和乙都为液态,甲中A、B原子数之比为2:1,乙中为1:1。由B、C组成的两种化合物丙和丁都为固态,丙中C、B原子数之比为2:1,丁中为1:1。C、D、E的最高价氧化物对应的水化物两两之间均能发生反应,且均有甲生成,且A为原子半径最小的短周期元素,丁为淡黄色固体。则:
(1)D的原子结构示意图为:__________________
(2)A元素的单质为:_____________(填化学式);丁的电子式为:_____________
(3)E在周期表中的位置_________________________________
(4)C、D的最高价氧化物对应水化物发生反应的离子方程式为:
____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用。
(1)已知相关热化学方程式为:
4Al(s)+3O2(g)=2Al2O2(s) △H1=a kJmol﹣1
3MnO2(s)=Mn3O4(s)+O2(g) △H2=bkJmol﹣1
3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) △H3=ckJmol﹣1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) △H=__ kJmol﹣1(用含a、b、c的代数式表示).
(2)MnCO3广泛用作锰盐原料.通过如图装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)。
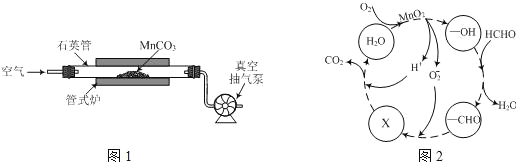
①2MnCO3(s)+O2(g)2MnO2(s)+2CO2(g)的化学平衡常数表达式K=______。
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还有______。
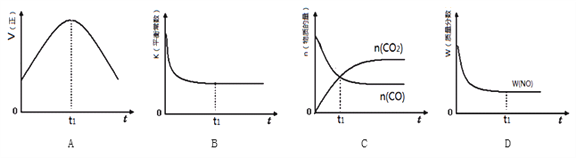
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中V正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(3)MnO2常用作催化剂。MnO2催化降解甲醛的反应机理如图所示,图中X表示的粒子是______,该反应的总反应方程式为______。
(4)MnSO4是重要微量元素肥料。用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:______,电解过程中阴极附近的pH______(选填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性的无色溶液中能大量共存的离子组是( )
A.NH4+、Mg2+、SO42﹣、Cl﹣ B.Ba2+、K+、OH﹣、NO3﹣
C.Al3+、Cu2+、SO42﹣、Cl﹣ D.Na+、Ca2+、Cl﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在有机物的分子中引入羟基官能团的反应类型有:(a)酯化反应,(b)取代反应,(c)氧化反应,(d)加成反应,(e)水解反应。其中正确的组合有
A. (a)(b)(c) B. (d)(e) C. (b)(d)(e) D. (b)(c)(d)(e)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL 0.3molL﹣1和300mL 0.25molL﹣1的硫酸注入500mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
A.0.21 molL﹣1
B.0.56 molL﹣1
C.0.42 molL﹣1
D.0.26 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.1molL﹣1NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
A.称量时,左盘低,右盘高 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol/L的盐酸,测得溶液中CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A.a曲线表示的离子方程式为AlO2-+H++H2O==Al(OH)3↓
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
C.V1∶V2=l∶5
D.M点时生成的CO2为0.05 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com