
【题目】锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用。
(1)已知相关热化学方程式为:
4Al(s)+3O2(g)=2Al2O2(s) △H1=a kJmol﹣1
3MnO2(s)=Mn3O4(s)+O2(g) △H2=bkJmol﹣1
3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) △H3=ckJmol﹣1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) △H=__ kJmol﹣1(用含a、b、c的代数式表示).
(2)MnCO3广泛用作锰盐原料.通过如图装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)。
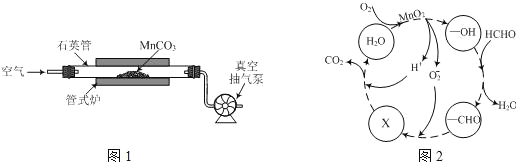
①2MnCO3(s)+O2(g)2MnO2(s)+2CO2(g)的化学平衡常数表达式K=______。
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还有______。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中V正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
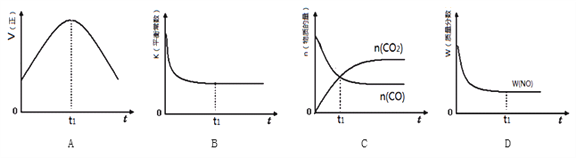
(3)MnO2常用作催化剂。MnO2催化降解甲醛的反应机理如图所示,图中X表示的粒子是______,该反应的总反应方程式为______。
(4)MnSO4是重要微量元素肥料。用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:______,电解过程中阴极附近的pH______(选填“增大”、“减小”或“不变”)
【答案】 3/4a+b+1/3c C2(CO2)/(CO2) 使平衡正向移动,提高MnCO3转化率 BD HCO3- HCHO+O2=CO2+H2O Mn2+-2e-+H2O2=MnO2+4H+ 增大
【解析】(1)已知:①.3MnO2(s)=Mn3O4(s)+O2(g)△H1=a kJmol-1
②.3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s)△H2=b kJmol-1
由Al的燃烧热可得:③.Al(s)+![]() O2(g)=
O2(g)=![]() Al2O3(s)△H=-c kJmol-1,
Al2O3(s)△H=-c kJmol-1,
根据盖斯定律,①+![]() ×②+
×②+![]() ×③可得:3MnO2(s)+4Al(s)═3Mn(s)+2Al2O3(s),则△H=(a+
×③可得:3MnO2(s)+4Al(s)═3Mn(s)+2Al2O3(s),则△H=(a+![]() b-
b-![]() c) kJmol-1;
c) kJmol-1;
(2)①2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO(g)的化学平衡常数表达式K=C2(CO2)/(CO2);
2MnO2(s)+2CO(g)的化学平衡常数表达式K=C2(CO2)/(CO2);
②用真空抽气泵不断抽气,可增大空气量,减少生成物浓度,平衡正向移动,可提高MnCO3的转化率;
③A.t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;B.t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故B正确;C.t1时二氧化碳和氧气的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误;D.t1时二氧化碳的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故D正确;故选BD;
(3)氧离子与-CHO转化为X,而X与H+生成CO2和H2O,则X表示的粒子是HCO3-,整个过程是甲醛氧化生成二氧化碳与水,可得该反应的总反应方程式为:HCHO+O2![]() CO2+H2O;
CO2+H2O;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,阴极水得电子发生还原反应生成氢气,总反应离子方程式为:Mn2++2H2O![]() MnO2+H2↑+2H+,阴极附近氢氧根浓度增大,则电解过程中阴极附近的pH增大。
MnO2+H2↑+2H+,阴极附近氢氧根浓度增大,则电解过程中阴极附近的pH增大。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】[2016新课标Ⅰ]化学与生活密切相关。下列有关说法错误的是
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为95%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业。碳化法生产碳酸钡的工艺流程示意图如下:
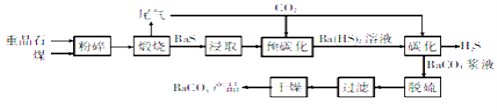
已知:重晶石的主要成分是BaSO4;Ba(HS)2溶液呈弱碱性;2BaS+2H2O=Ba(OH)2+Ba(HS)2。
回答下列问题:
(1)煅烧时发生反应的化学方程式为 ,该反应的氧化产物的电子式为 ;当温度过高时,尾气中有毒气体的含量会升高,原因是 (用化学方程式表示)。
(2)为了提高浸取速率,可采取的措施是 (任写一种)。
(3)碳化时发生反应的离子方程式为 。
(4)脱硫过程是用Na2CO3溶液将BaCO3浆液中含有的BaS2O3除去:CO32-+BaS2O3=BaCO3+S2O32-,该反应的平衡常数为 【已知Ksp(BaCO3)=2.5×10-9,Ksp(BaS2O3)=1.6×10-5】。
(5)Ba(HS)2溶液中离子浓度由大到小的顺序为 。
(6)BaCO3不能用于医疗用的“钡餐”,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。回答下列问题:

(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是___________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。 在装置中,仪器b的作用是____________;仪器c的名称是___________,其作用是___________。反应结束后加适量冷水,再分离出苯乙酸粗品。下列仪器中可用于分离苯乙酸粗品的是___________(填标号)。
A分液漏斗 B漏斗 C烧杯 D直形冷凝管 E玻璃棒
(3)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以重要的化工原料A(C2H2)合成有机物E和![]() 的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
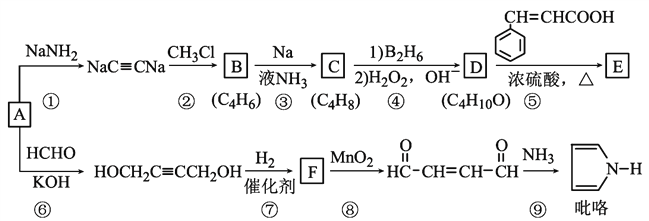
回答下列问题:
(1)B的系统命名是______;已知C是顺式产物,则C的结构简式为_______________。
(2)⑤的反应类型是_________________,E含有的官能团的名称是________________。
(3)反应⑧产物与新制Cu(OH)2的化学方程式为____________________。
(4)符合下列条件肉桂酸(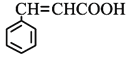 )的同分异构体共____种,分子中含有苯环和碳碳双键,能够发生银镜反应,遇FeCl3溶液显紫色,写出其中核磁共振氢谱图有六组峰,且峰面积之比为1:1:1:1:2:2的结构简式____________________
)的同分异构体共____种,分子中含有苯环和碳碳双键,能够发生银镜反应,遇FeCl3溶液显紫色,写出其中核磁共振氢谱图有六组峰,且峰面积之比为1:1:1:1:2:2的结构简式____________________
(5)参照上述合成路线,设计一条由丙炔和甲醛为起始原料制备![]() 的合成路线__________________________。
的合成路线__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组现使用酸碱中和滴定法测定某市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:(1)用________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀即得待测白醋溶液。
![]()
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴______作指示剂。
(3)读取盛装0.1000 mol·L-1 NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
(4)滴定。 当加入最后一滴溶液后,液体由无色变为浅红色,且30秒钟无变化时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)按实验所得数据,市售白醋总酸量=________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量待测液溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com