
【题目】斑蝥素具有良好的抗肿瘤活性。下列是斑蝥素的一种合成路线:

已知:ⅰ.其它条件不变,通常反应物浓度越大速率越快,多步反应时速率由最慢反应决定;
ⅱ.狄尔斯阿尔德反应:![]()
(1)有机化合物A的分子式为__。
(2)A转化为B时,路线Ⅰ和路线Ⅱ均在水溶液中进行。实验发现:路线Ⅰ比路线Ⅱ所需时间短,试解释原因__。
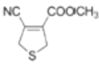
(3)写出B→C的化学方程式__。
(4)D与乙二醇发生缩聚反应的化学方程式为__。
(5)①X的结构简式是__。
②下表研究了__对合成F的影响,合成F的较优条件为__(填编号)。
编号 | 离子液体X | 反应温度/℃ | 反应时间/h | E含量/% | F含量/% | |
1 | [BPy]BF4 | 45 | 20 | 90 | 9 | |
2 | [HMIM]PF6 | 35 | 20 | 5 | 93 | |
3 | [BMIM]BF4 | 25 | 30 | 0 | 90 | |
4 | [HMIM]BF4 | 35 | 20 | 38 | 57 | |
5 | [BMIM]BF4 | 25 | 20 | 0 | 86 |
(6)请写出以![]() 为原料制备
为原料制备 的合成路线流程图__(无机试剂任选,合成路线流程图示见本题题干)。
的合成路线流程图__(无机试剂任选,合成路线流程图示见本题题干)。
【答案】C6H8O3S HCN为弱酸,其水溶液中CN-浓度远小于NaCN里的,因此路线I反应快,所需时间短 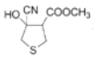
![]()
 +H2O n
+H2O n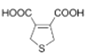 +nHOCH2CH2OH→
+nHOCH2CH2OH→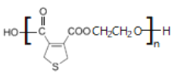 +(2n-1)H2O
+(2n-1)H2O ![]() 离子液体和反应温度 5
离子液体和反应温度 5 ![]()
![]()
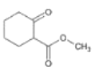
![]()
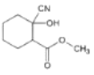
![]()

![]()
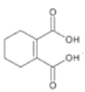
![]()
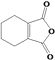
【解析】
(1)由A的结构简式可知,A分子中含有6个C原子、8个H原子、3个O原子、1个S原子;
(2)第一步为慢反应,溶液CN浓度越小反应速率越慢,HCN属于弱酸,其水溶液中CN浓度远小于NaCN;
(3)B→C转化是B分子内脱去1分子水形成碳碳双键生成C;
(4) 与HOCH2CH2OH发生缩聚反应生成
与HOCH2CH2OH发生缩聚反应生成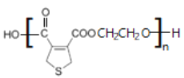 ;
;
(5)①由原子守恒可知,E→F的反应类型为加成反应,进而推断X的结构简式;
②由表中数据可知,研究了离子液体、反应温度对合成F的影响;在常温下反应,F的含量越高、E的含量越低越好;
(6)![]() 发生催化氧化生成
发生催化氧化生成 ,再与NaCN反应生成
,再与NaCN反应生成 ,然后与Py、POCl3反应生成
,然后与Py、POCl3反应生成 ,再与HCl/乙酸反应生成
,再与HCl/乙酸反应生成 ,最后在SOCl2作用下生成
,最后在SOCl2作用下生成 。
。
(1)由A的结构简式可知,A分子中含有6个C原子、8个H原子、3个O原子、1个S原子,故A的分子式为:C6H8O3S;
(2)酮与HCN或NaCN加成历程中第一步为慢反应,决定反应速率,HCN属于弱酸,其水溶液中CN浓度远小于NaCN,路线I的反应速率快,所需时间短;
(3)B→C转化是B分子内脱去1分子水形成碳碳双键生成C,反应方程式为:
![]()
 +H2O;
+H2O;
(4) 与HOCH2CH2OH发生缩聚反应生成
与HOCH2CH2OH发生缩聚反应生成 ,反应方程式为:n
,反应方程式为:n +nHOCH2CH2OH→
+nHOCH2CH2OH→ +(2n-1)H2O;
+(2n-1)H2O;
(5)①由原子守恒可知,E与X发生加成反应生成F,则X的结构简式为 ;
;
②由表中数据可知,研究了离子液体、反应温度对合成F的影响;合成F的较优条件为5,因为在[BMIM]BF4离子液体中,反应在常温条件下进行,得到F的含量高,而不含E;
(6) ![]() 发生催化氧化生成
发生催化氧化生成 ,再与NaCN反应生成
,再与NaCN反应生成 ,然后与Py、POCl3反应生成
,然后与Py、POCl3反应生成 ,再与HCl/乙酸反应生成
,再与HCl/乙酸反应生成 ,最后在SOCl2作用下生成
,最后在SOCl2作用下生成 ,合成路线流程图为:
,合成路线流程图为:![]()
![]()

![]()

![]()

![]()

![]()
 .
.


科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

组成M的元素中,电负性最大的是__________(填名称)。
(2)钛元素基态原子未成对电子数为________个,能量最高的电子占据的能级符号为________。
(3)①已知Al 的第一电离能为578 kJ·mol-1、第二电离能为1 817 kJ·mol-1、第三电离能为2 745 kJ·mol-1、第四电离能为11 575 kJ·mol-1。请解释其第二电离能增幅较大_______________________________。Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。
②第二电离能I(Cu)________(填“>”或“<”)I (Zn)。
(4)在硅酸盐中,SiO44—四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b)为一种无限长单链结构的多硅酸根(其中硅原子数为n):其中Si原子的杂化形式为_________,Si与O的原子数之比为__________,化学式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180kJ·mol1
2NO(g) ΔH1=+180kJ·mol1
②NO2(g)+CO(g)![]() NO(g)+CO2(g) ΔH2=-235kJ·mol1
NO(g)+CO2(g) ΔH2=-235kJ·mol1
③2NO(g)+O2(g)![]() 2NO2(g) ΔH3=-112kJ·mol1
2NO2(g) ΔH3=-112kJ·mol1
则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的ΔH=__kJ·mol1,有利于提高CO平衡转化率的条件是__(填标号)。
N2(g)+2CO2(g)的ΔH=__kJ·mol1,有利于提高CO平衡转化率的条件是__(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入2molNO、2molCO,达到平衡时CO的转化率是50%,其平衡常数为__。
(2)在密闭容器中充入10molCO和8molNO,发生反应,如下图为平衡时NO的体积分数与温度,压强的关系。
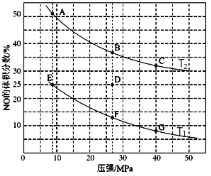
①由图判断,温度T1__T2(填“低于”或“高于”),理由是__?升高温度时,下列关于该反应的平衡常数(K)和速率(v)的叙述正确的是__填标号)。
A.K、V均增加 B.K增加,v减小
C.K减小,V增加 D.K、V均减小
②压强为20MPa、温度为T2下,若反应进行到10min达到平衡状态,容器的体积为2L,则此时CO的转化率=__,用CO2的浓度变化表示的平均反应速率v(CO2)=__,该温度下,如图所示A、B、C对应的pA(CO2)、pB(CO2)、pC(CO2)从大到小的顺序为__。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的__点。
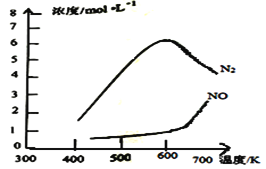
(3)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示。
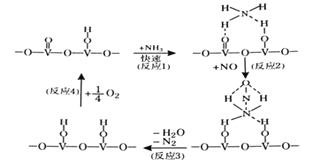
测得该反应的平衡常数与温度的关系为1gK=5.08+217.5/T,该反应是__反应(填“吸热”或“放热”)。该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为__;当温度达到700K时,发生副反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴乙烷(CHBr2—CHBr2)是一种无色透明液体,密度2.967g·mL-1,难溶于水,沸点244℃,可用作制造塑料的有效催化剂等。用电石(主要成分CaC2,少量CaS、Ca3P2、Ca3AS2等)和Br2等为原料制备少量四溴乙烷的装置(夹持装置已省略)如图1所示。
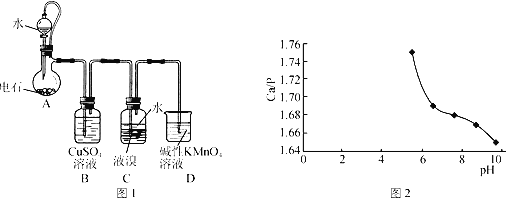
(1)装置A中CaC2能与水剧烈发生反应:CaC2+2H2O→Ca(OH)2+C2H2↑。为了得到平缓的C2H2气流,除可用饱和食盐水代替水外,还可采取的操作方法是__。
(2)装置B可除去H2S、PH3及AsH3,其中除去PH3的化学方程式为__(PH3还原性较强,氧化产物是磷酸)。
(3)装置C中在液溴液面上加入一层水的目的是__;装置C中反应已完成的现象是__;从装置C反应后的体系得到并纯化产品,需要进行的操作有__。
(4)一种制备Ca10(PO4)6(OH)2的原理为10Ca(OH)2+6H3PO4=Ca10(PO4)6(OH)2↓+18H2O。请设计用装置A得到的石灰乳等为原料制备Ca10(PO4)6(OH)2的实验方案:向烧杯中加入0.25L含0.5mol·L-1Ca(OH)2的石灰乳,_,在100℃烘箱中烘干1h。
已知:
①Ca10(PO4)6(OH)2中Ca/P比理论值为1.67。影响产品Ca/P比的主要因素有反应物投料比及反应液pH。
②在95℃,pH对Ca/P比的影响如图2所示。
③实验中须使用的试剂:含0.5mol·L-1Ca(OH)2的石灰乳、0.3mol·L-1磷酸及蒸馏水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M( )是合成药物瑞德西韦的中间体,其合成途径如图:
)是合成药物瑞德西韦的中间体,其合成途径如图:

已知:![]() +HCN→
+HCN→ (R和R′均表示烃基或氢原子)
(R和R′均表示烃基或氢原子)
完成下列填空:
(1)M中含氧官能团的名称为___。反应①~③中属于取代反应的有___。反应⑤的化学方程式为___。
(2)反应④需要在无水条件下进行,如何检验反应③所得产物中的水已被除净?___。
(3)写出两种满足下列条件的有机物的结构简式___。
①(C2H5)2CHOH的同分异构体,②能发生消除反应且只生成一种烯烃。
(4)聚甲基丙烯酸( )常用作胶黏剂、锅炉阻垢剂以及合成离子交换树脂。根据已有知识并结合题目流程中的信息,设计由丙酮(
)常用作胶黏剂、锅炉阻垢剂以及合成离子交换树脂。根据已有知识并结合题目流程中的信息,设计由丙酮(![]() )制备甲基丙烯酸(
)制备甲基丙烯酸(![]() )的合成路线___。
)的合成路线___。
(合成路线常用的表示方式为:A![]() B
B![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com