
【题目】下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
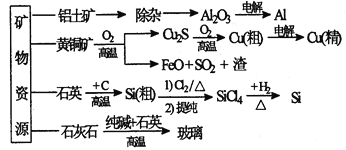
A. 粗铜电解精炼时,粗铜作阳极
B. 生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C. 黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】战国时成书的《尚书·洪范篇》有“稼稿作甘”之句,“甘”即饴糖,饴糖的主要成分是一种双糖,1 mol该双糖完全水解可生成2 mol葡萄糖。则饴糖的主要成分是
A. 果糖B. 淀粉C. 麦芽糖D. 蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列化学方程式:
(1)碳酸氢钠受热分解的方程式________________________________________
(2)NO2溶于水发生的反应____________________________________________
(3)NH3与O2的反应_________________________________________________
(4)HNO3见光或受热的分解反应_______________________________________
(5)Cu与稀HNO3的反应_____________________________________________
(6)Cu与浓H2SO4的反应_____________________________________________
(7)C与浓H2SO4的反应 _____________________________________________
(8)Mg与CO2的反应 ________________________________________________
(9)Al与Fe2O3高温条件下的铝热反应_____________________________________
(10)Al与NaOH溶液的反应___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成NH3,下列说法正确的是
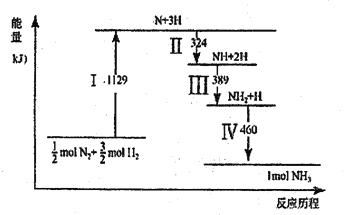
A. Ⅰ中破坏的均为极性键
B. Ⅱ、Ⅲ、Ⅳ均为放热过程
C. Ⅳ中NH2与H2生成NH3
D. N2(g)+3H2(g) ![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5,下列说法正确的是
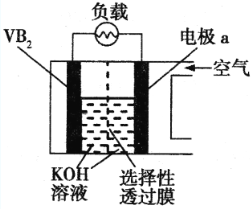
A.电极a为电池负极,发生还原反应
B.每消耗1molVB2转移6mol电子
C.电池工作时,OH向电极a移动
D.VB2极发生的电极反应为:2VB2+22OH-22e=V2O5+2B2O3+11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种锂铜可充电电池,工作原理如图所示。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON) 隔开。下列说法不正确的是
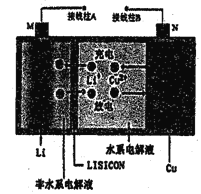
A. 充电时,接线柱A应与外接电源的正极相违
B. 放电时,N为电池的正极
C. 充电时,阴极反应为: Li++e-=Li
D. 陶瓷片允许Li+通过,不允许水分子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)
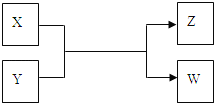
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是____________。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途_________________________。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到这种碘酸盐,此反应的离子方程式是______________________________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是__________________________________。
(2)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液_____mL (精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列判断中正确的是
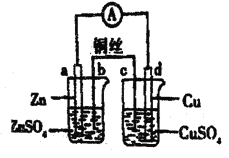
A. 电路中电子的流动方向为: adCuSO4(ag)cb
B. d电极反应式为: Cu2++2e-=Cu,反应后CuSO4溶液的浓度降低
C. C电极质量减少量等于d电极质量增加量
D. 该原电池原理为 Zn+ Cu2+= Zn2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:
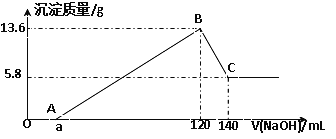
(1)写出OA段和BC段反应的离子方程式:OA:___________ ; BC:___________;
(2)原Mg-Al合金的质量是_____________。
(3)原NaOH溶液的物质的量浓度是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com