
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验I:将Fe3+转化为Fe2+
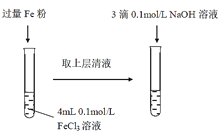
(1)常温下,FeCl3溶液显酸性,用离子方程式表示其显酸性的原因___。
(2)Fe3+与Fe粉发生反应的离子方程式为___。
(3)滴加NaOH溶液观察到的现象为___。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(4)用离子方程式解释NO产生的原因___。
(5)从化学反应限度的角度对体系中存在的反应进行反应I:Fe2+与HNO3反应;反应II:Fe2+与NO反应
①乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是___。
②查阅资料反应I的速率比反应II慢,请用化学平衡移动原理解释溶液由棕色变为黄色的原因___。
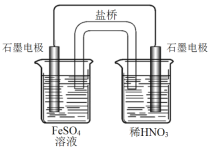
(6)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请画出实验装置图,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。___
Fe3+的转化,同时避免出现此异常现象。___
【答案】Fe3++3H2O![]() Fe(OH)3+3H+ Fe3++2Fe=3Fe2+ 有灰白色沉淀产生,迅速转变为灰绿色,最终转变为红褐色 3Fe2++4H+ +NO3-=3Fe3++NO↑+2H2O 取反应后的黄色溶液于试管中,向其中加入几滴K3Fe(CN)6溶液,无明显变化,说明反应Ⅰ是不可逆反应 Fe2+被HNO3氧化,导致Fe2+浓度降低,使平衡Fe2++NO
Fe(OH)3+3H+ Fe3++2Fe=3Fe2+ 有灰白色沉淀产生,迅速转变为灰绿色,最终转变为红褐色 3Fe2++4H+ +NO3-=3Fe3++NO↑+2H2O 取反应后的黄色溶液于试管中,向其中加入几滴K3Fe(CN)6溶液,无明显变化,说明反应Ⅰ是不可逆反应 Fe2+被HNO3氧化,导致Fe2+浓度降低,使平衡Fe2++NO![]() Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色
Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色 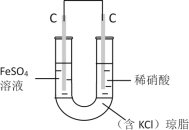
【解析】
常温下,Fe3+水解使溶液呈酸性,Fe3++3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
Fe3+与Fe粉发生反应的离子方程式为Fe3++2Fe=3Fe2+;
滴加NaOH溶液观察到的现象为有灰白色沉淀产生,迅速转变为灰绿色,最终转变为红褐色;
由于发生氧化还原反应,产生NO,方程式为3Fe2++4H+ +NO3-=3Fe3++NO↑+2H2O;
①取反应后的黄色溶液于试管中,向其中加入几滴K3Fe(CN)6溶液,无明显变化,说明反应Ⅰ是不可逆反应;
②Fe2+被HNO3氧化,导致Fe2+浓度降低,使平衡Fe2++NO![]() Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色;
Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色;
丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,可设计为双液原电池,实现Fe2+![]() Fe3+的转化,
Fe3+的转化, 。
。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3可作食用碱。下列方程式中正确的是( )
A.Na2O2与CO2反应生成Na2CO3:Na2O2 +CO2=Na2CO3+O2
B.Na2CO3溶液呈碱性:CO32-+H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.NaHCO3可作发酵粉:2NaHCO3![]() Na2CO3+CO2↑ +H2O
Na2CO3+CO2↑ +H2O
D.Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.向稀苯酚溶液中加入少量稀溴水,无现象,是因为不能发生取代反应
B.实验室进行石油的蒸馏、乙酸乙酯的制取、乙烯的制取实验时均需要使用温度计
C.将红热的铜丝迅速插入乙醇中,反复多次,可观察到铜丝表面变黑,并能闻到香味
D.用强光照射盛有CH4与Cl2(体积比1:4)的集气瓶后,可观察到瓶内壁附有油状物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像布袋结构的烯烃分子,其形状和结构如图所示,有关说法不正确的是( )

A. 该烯烃的分子式为C5H4
B. 该分子所有碳原子在同一平面
C. 1 mol该有机物最多可与2 mol Br2发生加成反应
D. 与其互为同分异构体且只含三键的链烃不止—种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D. =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
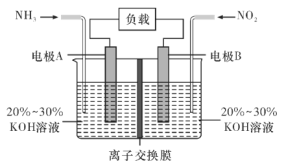
(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出酒驾测定中电池总反应方程式:______________________________,负极反应方程式:____________________________。
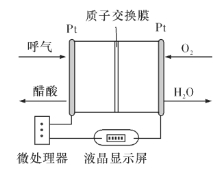
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com